L’acide ascorbique (C6H8O6) est une vitamine présente dans divers fruits et légumes. Il aide le corps à absorber le fer, renforce le système immunitaire et favorise la production de collagène pour une peau saine.
| Nom UICPA | (5R)-[(1S)-1,2-dihydroxyéthyl]-3,4-dihydroxyfuran-2(5H)-one |
| Formule moléculaire | C6H8O6 |
| Numero CAS | 50-81-7 |
| Synonymes | Vitamine C, acide L-ascorbique, 3-céto-L-gulofuranolactone, vitamine antiscorbutique, L-ascorbate |
| InChI | InChI=1S/C6H8O6/c7-1-2(8)5-3(9)4(10)6(11)12-5/h2,5,7-10H,1H2 |
Propriétés de l’acide ascorbique
Formule d’acide ascorbique
La formule de l’acide ascorbique est C6H8O6. Il se compose de six atomes de carbone, huit atomes d’hydrogène et six atomes d’oxygène. Cette formule moléculaire représente la disposition spécifique et la quantité d’atomes dans une molécule d’acide ascorbique.
Acide Ascorbique Masse molaire
La masse molaire du L-ascorbate est d’environ 176,12 grammes par mole. La masse molaire fait référence à la masse d’une mole d’une substance et est calculée en additionnant les masses atomiques de tous les atomes de la formule.
Point d’ébullition de l’acide ascorbique
Le point d’ébullition du L-ascorbate est d’environ 553 degrés Celsius (1 027 degrés Fahrenheit). C’est la température à laquelle la forme liquide du L-ascorbate se transforme en phase gazeuse en surmontant les forces intermoléculaires qui maintiennent les molécules ensemble.
Acide ascorbique Point de fusion
Le point de fusion du L-ascorbate est d’environ 190 à 192 degrés Celsius (374 à 378 degrés Fahrenheit). Il s’agit de la température à laquelle la forme solide du L-ascorbate se transforme en état liquide en raison de la rupture des liaisons intermoléculaires.
Densité d’acide ascorbique g/mL
La densité du L-ascorbate est d’environ 1,65 grammes par millilitre. La densité représente la masse d’une substance par unité de volume et est une mesure de la densité des molécules dans un espace donné.
Acide ascorbique Poids moléculaire
Le poids moléculaire du L-ascorbate est d’environ 176,12 grammes par mole. Le poids moléculaire, également appelé masse moléculaire, fait référence à la somme des poids atomiques de tous les atomes d’une molécule.
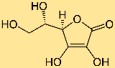
Structure de l’acide ascorbique
Le L-ascorbate a une structure cyclique connue sous le nom de lactone. Il se compose d’un cycle à cinq chaînons avec une double liaison et d’un cycle à six chaînons. La molécule contient également des groupes hydroxyle (-OH) et un groupe carbonyle (C=O), qui contribuent à ses propriétés chimiques.
Solubilité de l’acide ascorbique
Le L-ascorbate est hautement soluble dans l’eau. Il se dissout facilement dans l’eau en raison de la présence de groupes hydrophiles (-OH) dans sa structure, lui permettant de former des liaisons hydrogène avec les molécules d’eau. Cette solubilité permet au corps d’absorber et d’utiliser facilement le L-ascorbate lorsqu’il est ingéré.
| Apparence | Cristaux blancs |
| Gravité spécifique | 1,65 g/ml |
| Couleur | Blanc |
| Odeur | Inodore ou faible |
| Masse molaire | 176,12 g/mole |
| Densité | 1,65 g/ml |
| Point de fusion | 190-192 °C (374-378 °F) |
| Point d’ébullition | 553 °C (1 027 °F) |
| Point d’éclair | N / A |
| Solubilité dans l’eau | Très soluble |
| Solubilité | Soluble dans l’eau, l’éthanol |
| Pression de vapeur | 0,000087 mmHg |
| Densité de vapeur | N / A |
| pKa | 4,17 (à 25°C) |
| pH | 2,2-2,8 (solution à 5 %) |
Sécurité et dangers de l’acide ascorbique
Le L-ascorbate est généralement considéré comme sans danger pour la consommation et l’utilisation lorsqu’il est utilisé selon les instructions. Cependant, une consommation excessive de L-ascorbate sous forme de supplément peut entraîner des problèmes digestifs, tels que de la diarrhée ou des crampes d’estomac. Il est important de suivre les directives posologiques recommandées. Dans de rares cas, des réactions allergiques peuvent survenir, provoquant des symptômes tels qu’une éruption cutanée, des démangeaisons ou des difficultés respiratoires. Lors de la manipulation de poudre concentrée de L-ascorbate, il est conseillé de porter des gants de protection et d’éviter d’inhaler la poudre pour éviter toute irritation. Le L-ascorbate doit être conservé dans un endroit frais et sec, à l’abri de la lumière directe du soleil et hors de portée des enfants.
| Symboles de danger | Aucun |
| Description de la sécurité | Nocif en cas d’ingestion. Provoque une légère irritation de la peau et des yeux. Évitez l’inhalation. |
| Numéros d’identification de l’ONU | N / A |
| Code SH | 29362700 |
| Classe de danger | Non classés |
| Groupe d’emballage | Non classés |
| Toxicité | Faible toxicité. Cependant, une consommation excessive peut entraîner des problèmes digestifs. |
Veuillez noter que le L-ascorbate est généralement considéré comme sans danger pour la consommation et ne porte aucun symbole de danger spécifique, identifiant ONU, classe de danger ou classification de groupe d’emballage.
Méthodes de synthèse de l’acide ascorbique
Dans un premier temps, la conversion du sorbitol synthétise le L-sorbose.
Le procédé Reichstein synthétise le L-ascorbate en soumettant le D- glucose à une hydrogénation catalytique, entraînant la conversion du D- glucose en D-sorbitol. Un processus de fermentation microbienne oxyde ensuite le D-sorbitol en L-sorbose. Les réactions chimiques ultérieures transforment le L-sorbose en acide 2-céto-L-gulonique. Enfin, un processus de réduction convertit l’acide 2-céto-L-gulonique en L-ascorbate.
Le procédé Reichstein-Grüssner fournit une méthode plus efficace et plus rentable pour synthétiser le L-ascorbate à partir du D- glucose . Ce processus implique une série de réactions d’oxydation, d’isomérisation et de réduction qui donnent finalement du L-ascorbate.
Une autre méthode en deux étapes utilise le sorbitol comme matière première. Dans un deuxième temps, une réaction de réduction convertit le L-sorbose en L-ascorbate pour le synthétiser.
Il est important de noter que bien que le L-ascorbate puisse être synthétisé, il est également naturellement présent dans divers fruits et légumes, ce qui le rend facilement disponible via des sources alimentaires.
Utilisations de l’acide ascorbique
- Le L-ascorbate, également connu sous le nom de vitamine C, contribue largement au maintien de la santé et du bien-être en général.
- Les gens l’utilisent principalement comme complément alimentaire pour prévenir ou traiter une carence en vitamine C, qui peut provoquer des maladies comme le scorbut.
- En tant que puissant antioxydant, le L-ascorbate protège les cellules des dommages causés par les radicaux libres, renforçant ainsi la santé du système immunitaire.
- Il joue un rôle crucial dans la synthèse du collagène, dans la promotion d’une peau saine, dans la cicatrisation des plaies et dans le maintien de la santé des tissus conjonctifs.
- Le L-ascorbate aide à l’absorption du fer contenu dans les aliments à base de plantes, améliorant ainsi l’anémie ferriprive.
- Les fabricants l’ajoutent généralement aux aliments comme antioxydant pour prévenir l’oxydation et prolonger la durée de conservation de divers produits.
- Les cosmétiques et les produits de soin de la peau contiennent du L-ascorbate pour ses propriétés éclaircissantes et anti-âge pour la peau.
- Certaines boissons et aliments contiennent du L-ascorbate ajouté pour améliorer leur teneur en vitamine C et offrir des avantages nutritionnels.
- L’industrie pharmaceutique utilise le L-ascorbate comme ingrédient dans la formulation de médicaments et de suppléments.
Dans l’ensemble, le L-ascorbate joue un rôle essentiel dans divers secteurs, notamment les industries de la santé, de la nutrition, des cosmétiques et de l’alimentation, en raison de ses nombreuses propriétés et applications bénéfiques.
Des questions:
Q : L’acide citrique et l’acide ascorbique sont-ils identiques ?
R : Non, l’acide citrique et le L-ascorbate sont des composés différents avec des structures et des propriétés chimiques distinctes.
Q : Quelle vitamine est connue sous le nom d’acide ascorbique ?
R : La vitamine C est connue sous le nom de L-ascorbate.
Q : À quoi sert l’acide ascorbique ?
R : Le L-ascorbate est utilisé à diverses fins, notamment la supplémentation alimentaire, la protection antioxydante, la synthèse du collagène et l’amélioration de l’absorption du fer.
Q : L’acide citrique et l’acide ascorbique sont-ils identiques ?
R : Non, l’acide citrique et le L-ascorbate sont des composés différents avec des structures et des propriétés chimiques distinctes.
Q : Quelle est la formule empirique de l’acide ascorbique, étant donné que la pseudo-formule est c3.407h4.53o3.406 ?
R : La formule empirique du L-ascorbate est C6H8O6.
Q : Quel atome H de la vitamine C (acide ascorbique) est le plus acide ? Sélectionnez la meilleure réponse.
R : L’atome H sur le groupe carboxyle (–COOH) du L-ascorbate est le plus acide.
Q : L’acide ascorbique est-il mauvais pour vous ?
R : Le L-ascorbate est généralement sans danger pour la consommation aux doses recommandées, mais une consommation excessive peut entraîner des problèmes digestifs. Consultez un professionnel de la santé pour des préoccupations spécifiques.
Q : Quel est le pH de l’acide ascorbique ?
R : Le L-ascorbate a une plage de pH d’environ 2,2 à 2,8 dans une solution à 5 %.
