L’acétate d’éthyle est un liquide incolore à l’odeur fruitée. Il est couramment utilisé comme solvant dans diverses industries, notamment pharmaceutique, cosmétique et alimentaire. L’acétate d’éthyle est hautement inflammable et doit être manipulé avec précaution.
| Nom UICPA | Acétate d’éthyle |
| Formule moléculaire | C4H8O2 |
| Numero CAS | 141-78-6 |
| Synonymes | Ester éthylique d’acide acétique, Éthanoate d’éthyle, Acétoxyéthane, Acétidine, Acétate d’éthyle, Ester acétique d’éthyle |
| InChI | InChI=1S/C4H8O2/c1-3-6-4(2)5/h3H2,1-2H3 |
Propriétés de l’acétate d’éthyle
Densité de l’acétate d’éthyle g/ml
La densité de l’éthanoate d’éthyle est de 0,902 g/ml dans des conditions standards de température et de pression. Cette densité indique que l’éthanoate d’éthyle est moins dense que l’eau et flottera au-dessus. Cette propriété le rend utile pour séparer des mélanges liquides grâce au processus d’extraction liquide-liquide.
Structure de l’acétate d’éthyle
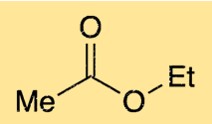
La structure de l’éthanoate d’éthyle est constituée d’une chaîne à quatre carbones avec un groupe fonctionnel ester. Le groupe fonctionnel ester est constitué d’un atome d’oxygène lié à un atome de carbone, lui-même lié à un autre atome d’oxygène. L’atome d’oxygène sur le groupe ester est également lié à l’un des atomes de carbone de la chaîne à quatre carbones. Cette structure confère à l’éthanoate d’éthyle son odeur fruitée caractéristique.
Masse molaire d’acétate d’éthyle
La masse molaire de l’acétate d’éthyle est de 88,11 g/mol. Il est déterminé en additionnant les poids atomiques de tous les atomes d’une molécule d’acétate d’éthyle. La formule moléculaire de l’acétate d’éthyle est C4H8O2, ce qui indique qu’il y a 4 atomes de carbone, 8 atomes d’hydrogène et 2 atomes d’oxygène dans chaque molécule. La masse molaire de l’acétate d’éthyle est utilisée dans de nombreux calculs, tels que la détermination de la quantité de substance dans un échantillon donné ou de la masse d’une substance dans un volume donné.
Point d’ébullition de l’acétate d’éthyle
Le point d’ébullition de l’éthanoate d’éthyle est de 77,1 °C (171,8 °F) à pression standard. L’éthanoate d’éthyle a un point d’ébullition relativement bas, ce qui le rend utile dans de nombreuses applications industrielles comme solvant pour l’extraction, la purification et le nettoyage. Lorsqu’il est chauffé jusqu’à son point d’ébullition, l’éthanoate d’éthyle se vaporise et peut être collecté sous forme de liquide pur par condensation.
Point de fusion de l’acétate d’éthyle
Le point de fusion de l’éthanoate d’éthyle est de -83,6 °C (-118,5 °F). Ce faible point de fusion signifie que l’éthanoate d’éthyle est généralement rencontré sous forme liquide plutôt que solide à température ambiante. Cependant, il peut se solidifier à des températures extrêmement basses ou sous pression. La forme solide de l’éthanoate d’éthyle est généralement une poudre cristalline blanche.
Poids moléculaire de l’acétate d’éthyle
Le poids moléculaire de l’éthanoate d’éthyle est de 88,11 g/mol. Cette valeur représente la masse d’une mole de molécules d’éthanoate d’éthyle. Le poids moléculaire est utilisé dans de nombreux calculs, tels que la détermination de la quantité de substance dans un échantillon donné ou de la masse d’une substance dans un volume donné.
Formule d’acétate d’éthyle
La formule chimique de l’éthanoate d’éthyle est C4H8O2. Cette formule représente le nombre et le type d’atomes qui composent une molécule d’éthanoate d’éthyle. Les quatre atomes de carbone de la formule sont disposés en chaîne, chaque atome de carbone étant lié à deux autres atomes. Deux des atomes de carbone sont également liés aux atomes d’oxygène dans le groupe fonctionnel ester. Les deux atomes de carbone restants sont chacun liés à trois atomes d’hydrogène.
| Apparence | Liquide incolore |
| Gravité spécifique | 0,902 g/cm³ |
| Couleur | Incolore |
| Odeur | Fruité, sucré |
| Masse molaire | 88,11 g/mole |
| Densité | 0,902 g/cm³ |
| Point de fusion | -83,6 °C |
| Point d’ébullition | 77,1°C |
| Point d’éclair | -4°C |
| Solubilité dans l’eau | 80 g/L à 20°C |
| Solubilité | Soluble dans l’alcool, l’éther, l’acétone, le chloroforme |
| Pression de vapeur | 73,3 mmHg à 20°C |
| Densité de vapeur | 3.04 |
| pKa | 4,76 |
| pH | Neutre |
L’éthanoate d’éthyle est un liquide incolore largement utilisé dans diverses applications industrielles et de laboratoire. Cependant, il présente certains risques pour la sécurité et la santé qui doivent être pris en compte pour garantir une manipulation et une utilisation sûres. L’exposition à l’éthanoate d’éthyle peut provoquer une irritation des yeux, de la peau et du système respiratoire. Cela peut également provoquer des maux de tête, des étourdissements et des nausées. L’éthanoate d’éthyle est inflammable et peut provoquer des incendies ou des explosions s’il est exposé à la chaleur ou aux flammes. Il est important de stocker et de manipuler l’éthanoate d’éthyle dans un endroit bien ventilé, loin des sources d’inflammation. En cas d’exposition accidentelle, des soins médicaux immédiats doivent être recherchés pour éviter d’autres dommages. Des précautions de sécurité et un équipement de protection appropriés doivent être utilisés lors de la manipulation de l’éthanoate d’éthyle afin de minimiser le risque de blessure ou de dommage.
| Symboles de danger | Xi, F |
| Description de la sécurité | Eviter le contact avec la peau et les yeux. Tenir à l’écart des sources d’ignition. Utiliser dans un endroit bien ventilé. |
| Identifiants ONU | UN1173 |
| Code SH | 2915.31.00 |
| Classe de danger | 3 – Liquides inflammables |
| Groupe d’emballage | GE II |
| Toxicité | DL50 (orale, rat) – 2 g/kg |
Méthodes de synthèse de l’acétate d’éthyle
Deux méthodes principales, l’estérification et la déshydrogénation, synthétisent activement l’éthanoate d’éthyle dans l’industrie avec des rendements élevés.
La méthode d’estérification implique la réaction entre l’éthanol et l’acide acétique en présence d’un catalyseur acide fort, tel que l’acide sulfurique. La distillation sépare l’éthanoate d’éthyle et l’eau, résultant de la réaction, pour produire des rendements élevés d’éthanoate d’éthyle, que l’industrie utilise couramment.
La méthode de déshydrogénation implique la réaction de l’éthanol et de l’acide acétique sur un catalyseur d’oxyde de cuivre (II) à haute température. Le catalyseur favorise la déshydrogénation de l’éthanol pour produire de l’éthylène, qui réagit ensuite avec l’acide acétique pour former de l’éthanoate d’éthyle. Cette méthode est moins courante que l’estérification et nécessite généralement des températures plus élevées et des temps de réaction plus longs.
Une autre méthode de synthèse de l’éthanoate d’éthyle consiste à faire réagir l’éthanol et l’anhydride acétique. Cette méthode aboutit à la production d’éthanoate d’éthyle et d’acide acétique, qui peuvent être séparés par distillation.
Utilisations de l’acétate d’éthyle
L’éthanoate d’éthyle est un composé chimique polyvalent qui est largement utilisé dans diverses applications industrielles et grand public. Certaines des utilisations les plus courantes de l’éthanoate d’éthyle sont :
- Solvant : Les fabricants l’utilisent comme solvant puissant dans les peintures, les revêtements et les adhésifs.
- Agent aromatisant : utilisé comme agent aromatisant dans l’industrie agroalimentaire et des boissons, en particulier dans la production de boissons aromatisées aux fruits.
- Parfum : ingrédient commun dans les parfums, les eaux de Cologne et autres produits de soins personnels en raison de son agréable odeur fruitée.
- Extraction d’huiles essentielles : Utilisé dans l’extraction d’huiles essentielles de plantes et de fleurs.
- Produits pharmaceutiques : Utilisés comme solvant dans la production de produits pharmaceutiques, en particulier dans la fabrication d’antibiotiques.
- Agent nettoyant : utilisé pour nettoyer les appareils électroniques, les textiles et autres matériaux.
- Cuir artificiel : Les fabricants de cuir artificiel adoucissent et rendent le matériau plus souple en utilisant de l’acétate d’éthyle comme plastifiant.
- Intermédiaire chimique : les producteurs de produits chimiques créent d’autres produits chimiques, tels que l’acétate de cellulose, l’acétate de vinyle et l’acrylate d’éthyle, en utilisant l’éthanoate d’éthyle comme intermédiaire chimique.
Des questions:
Q : L’acétate d’éthyle est-il polaire ou non polaire ?
R : L’éthanoate d’éthyle est un solvant polaire en raison de la présence du groupe carbonyle (C=O) et de l’atome d’oxygène dans sa structure moléculaire. Cependant, il n’est pas aussi polaire que d’autres solvants comme l’eau ou l’éthanol.
Q : L’acétate d’éthyle est-il miscible à l’eau ?
R : L’éthanoate d’éthyle n’est pas miscible à l’eau, ce qui signifie qu’il ne se mélange pas bien avec l’eau. Cela est dû à la différence de polarité entre les deux substances, car l’eau est un solvant hautement polaire et l’éthanoate d’éthyle est un solvant moins polaire.
Q : L’acétate d’éthyle est-il soluble dans l’eau ?
R : L’éthanoate d’éthyle est légèrement soluble dans l’eau, avec une solubilité d’environ 8 % à température ambiante. Cependant, cette solubilité est limitée en raison de la différence de polarité entre les deux substances. L’éthanoate d’éthyle est plus soluble dans les solvants non polaires tels que l’hexane ou le toluène.
