L’acétate de sodium (C2H3NaO2) est un composé composé d’ions Na+ et C2H3O2-. Il est couramment utilisé comme additif alimentaire et dans des applications médicales, comme dans les solutions de dialyse, et comme source de carbone pour certaines bactéries.
| Nom UICPA | L’acétate de sodium |
| Formule moléculaire | C2H3NaO2 |
| Numero CAS | 127-09-3 |
| Synonymes | Sel de sodium de l’acide acétique, éthanoate de sodium, Natriumacetat |
| InChI | InChI=1S/C2H4O2.Na/c1-2(3)4;/h1H3,(H,3,4);/q;+1/p-1 |
Propriétés de l’acétate de sodium
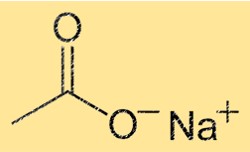
Formule d’acétate de sodium
La formule chimique de l’acétate de sodium est NaC2H3O2. Cela indique que le composé est composé d’un ion Na+ et d’un ion C2H3O2-. L’ion C2H3O2- est composé d’un atome de carbone, de deux atomes d’oxygène et de trois atomes d’hydrogène. La formule est utile pour déterminer la stœchiométrie des réactions chimiques et pour prédire le comportement du composé dans différentes conditions.
Acétate De Sodium Masse molaire
NaC2H3O2 a une masse molaire de 82,03 g/mol. Cela signifie qu’une mole de NaC2H3O2 pèse 82,03 grammes. La masse molaire est calculée en additionnant les masses atomiques de chaque élément du composé. Le sodium a une masse de 22,99 g/mol, le carbone a une masse de 12,01 g/mol, l’hydrogène a une masse de 1,01 g/mol et l’oxygène a une masse de 16,00 g/mol. La masse molaire de NaC2H3O2 est utile pour déterminer la quantité de composé présente dans un échantillon donné.
Point d’ébullition de l’acétate de sodium
NaC2H3O2 a un point d’ébullition de 881 °C (1 618 °F). Le point d’ébullition est la température à laquelle une substance passe de l’état liquide à l’état gazeux. Le point d’ébullition élevé de NaC2H3O2 est dû aux fortes liaisons ioniques entre les ions sodium et acétate. À haute température, ces liaisons sont rompues et le composé se vaporise.
Acétate de sodium Point de fusion
NaC2H3O2 a un point de fusion de 324 °C (615 °F). Le point de fusion est la température à laquelle une substance passe de l’état solide à l’état liquide. Le point de fusion élevé de NaC2H3O2 est également dû aux fortes liaisons ioniques entre les ions sodium et acétate. À haute température, ces liaisons sont affaiblies et le composé fond.
Densité d’acétate de sodium g/mL
NaC2H3O2 a une densité de 1,45 g/mL. La densité est la quantité de masse par unité de volume d’une substance. La densité élevée de NaC2H3O2 est due à la disposition compacte de ses molécules. La densité de NaC2H3O2 peut varier en fonction de sa concentration dans une solution.
Acétate De Sodium Poids moléculaire
Le poids moléculaire de NaC2H3O2 est de 82,03 g/mol. C’est la masse d’une mole du composé. Le poids moléculaire est utile pour déterminer la quantité d’un composé dans un échantillon donné, ainsi que pour calculer la stœchiométrie des réactions chimiques.
Structure de l’acétate de sodium
NaC2H3O2 a une structure cristalline avec une unité répétitive Na(CH3COO). Cela signifie que chaque cellule unitaire du cristal contient un ion sodium et un ion acétate. L’ion Na+ est entouré de six atomes d’oxygène, tandis que l’ion C2H3O2- est composé d’un atome de carbone, de deux atomes d’oxygène et de trois atomes d’hydrogène. Les fortes liaisons ioniques entre les ions confèrent au cristal sa stabilité et ses points de fusion et d’ébullition élevés.
| Apparence | Solide cristallin blanc |
| Gravité spécifique | 1,45 à 20°C |
| Couleur | Incolore ou blanc |
| Odeur | Inodore |
| Masse molaire | 82,03 g/mole |
| Densité | 1,45 g/cm³ à 20°C |
| Point de fusion | 324°C (615°F) |
| Point d’ébullition | 881°C (1618°F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | 820 g/L (20°C) |
| Solubilité | Soluble dans l’eau, l’éthanol, l’acétone |
| Pression de vapeur | 1 mm Hg à 239,2 °C |
| Densité de vapeur | N’est pas applicable |
| pKa | 4,76 (à 25°C) |
| pH | 7 (solution à 1%) |
Sécurité et dangers de l’acétate de sodium
NaC2H3O2 est généralement considéré comme sûr à manipuler et à utiliser lorsque les précautions appropriées sont prises. Cependant, il peut provoquer une irritation de la peau et des yeux, et l’ingestion ou l’inhalation de grandes quantités peut entraîner une irritation gastro-intestinale, des problèmes respiratoires et une dépression du système nerveux central. NaC2H3O2 peut également réagir avec des agents oxydants puissants, des acides et des alcalis, générant de la chaleur et des gaz dangereux. Il est important de porter un équipement de protection individuelle approprié lors de la manipulation du NaC2H3O2, notamment des gants et une protection oculaire. NaC2H3O2 doit être stocké dans un endroit frais, sec et bien ventilé, à l’écart des substances incompatibles. En cas d’exposition ou d’ingestion accidentelle, consulter immédiatement un médecin.
| Symboles de danger | Aucun |
| Description de la sécurité | Eviter le contact avec la peau et les yeux. Ne pas ingérer ni inhaler. Utiliser dans des zones bien ventilées. |
| Numéros d’identification de l’ONU | Non réglementé |
| Code SH | 2915.21.00 |
| Classe de danger | Non classés |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | Faible toxicité |
Méthodes de synthèse de l’acétate de sodium
Il existe plusieurs méthodes pour synthétiser NaC2H3O2, mais la plus courante implique la réaction de neutralisation de l’acide acétique et de l’hydroxyde de sodium . L’équation de la réaction est la suivante :
CH3COOH + NaOH → CH3COONa + H2O
Pour réaliser la réaction, une solution d’acide acétique est d’abord préparée en dissolvant de l’acide acétique glacial dans l’eau. Tout en remuant, ajoutez lentement de l’hydroxyde de sodium à la solution d’acide acétique jusqu’à ce que le pH de la solution atteigne environ 7.
À ce stade, la solution contiendra NaC2H3O2 et de l’eau. Pour obtenir du NaC2H3O2 solide, on peut évaporer la solution à chaleur douce jusqu’à ce qu’elle sèche. Alternativement, on peut laisser la solution refroidir à température ambiante et les cristaux de NaC2H3O2 précipiteront d’eux-mêmes.
Une autre méthode de synthèse de NaC2H3O2 consiste à faire réagir entre l’anhydride acétique et le carbonate de sodium . L’équation de la réaction est la suivante :
2 (CH3CO)2O + Na2CO3 → 2 CH3COONa + CO2 + CO + H2O
Cette réaction produit du NaC2H3O2, du dioxyde de carbone, du monoxyde de carbone et de l’eau.
L’évaporation du mélange réactionnel à sec puis sa cristallisation dans l’eau peuvent donner NaC2H3O2 sous forme solide. Le coût élevé de l’anhydride acétique rend cette méthode peu utilisée.
Utilisations de l’acétate de sodium
NaC2H3O2 est un produit chimique polyvalent avec de nombreuses applications industrielles et scientifiques. Voici quelques-unes de ses utilisations courantes :
- Agent tampon : Couramment utilisé comme agent tampon dans les applications chimiques et biologiques. Il aide à maintenir un pH stable et à prévenir les fluctuations d’acidité.
- Packs chauffants : Utilisés dans la production de packs chauffants ou de coussins chauffants. Ces sacs sont petits et peuvent chauffer pour fournir de la chaleur à une zone spécifique du corps.
- Additif alimentaire : utilisé comme additif alimentaire, principalement comme exhausteur de goût, régulateur de pH et conservateur. Les fabricants d’aliments transformés l’incluent généralement dans les collations, les sauces et les produits carnés.
- Industrie textile : Utilisé dans l’industrie textile comme auxiliaire de teinture et d’impression. Il contribue à améliorer l’absorption des teintures et la solidité des couleurs des tissus.
- Synthèse chimique : Utilisé comme réactif dans diverses réactions chimiques. Il convertit les alcools en halogénures d’alkyle correspondants et produit de l’anhydride acétique à partir de l’acide acétique.
- Applications médicales : Utilisé dans des applications médicales telles que l’hémodialyse et comme composant de solutions électrolytiques.
- Photographie : utilisé en photographie comme solution fixatrice pour éliminer les halogénures d’argent non exposés des tirages photographiques et des négatifs.
Des questions:
Q : Quel est le but de l’acétate de sodium dans la synthèse de l’amide ?
R : NaC2H3O2 est utilisé dans la synthèse de l’amide comme base pour déprotoner le groupe amine du matériau de départ. Cela facilite la réaction avec l’acide carboxylique pour former la liaison amide.
Q : Quel est le but de la solution d’acétate de sodium dans la synthèse de l’amide ?
R : La solution NaC2H3O2 est utilisée comme catalyseur basique dans la synthèse de l’amide. Il aide à déprotoner le groupe amine du matériau de départ, le rendant plus réactif envers l’acide carboxylique.
Q : L’acétate de sodium est-il une base ?
R : Oui, NaC2H3O2 est une base. C’est la base conjuguée de l’acide acétique et a un pH d’environ 9 lorsqu’elle est dissoute dans l’eau.
Q : Qu’est-ce que l’acétate de sodium ?
R : NaC2H3O2 est un sel de sodium de l’acide acétique, de formule chimique NaCH3COO. C’est une poudre blanche, inodore et cristalline, soluble dans l’eau.
Q : Quel est le but de la solution d’acétate de sodium dans la synthèse de l’amide de l’acétophénétidine ?
R : Dans la synthèse amide de l’acétophénétidine, la solution NaC2H3O2 est utilisée comme catalyseur basique pour faciliter la réaction entre la p-phénétidine et l’anhydride acétique. Il aide à déprotoner le groupe amine de la p-phénétidine et à l’activer vers une attaque nucléophile par l’anhydride acétique. Il en résulte la formation d’acétophénétidine.
