L’acétate de potassium (C2H3KO2) est un composé composé de potassium, de carbone, d’hydrogène et d’oxygène. Il est couramment utilisé dans l’industrie alimentaire comme conservateur et comme dégivreur pour les pistes d’aéroport.
| Nom de l’UICPA | Acétate de potassium |
| Formule moléculaire | C2H3KO2 |
| Numero CAS | 127-08-2 |
| Synonymes | KAc, éthanoate de potassium |
| InChI | InChI=1S/C2H4O2.K/c1-2(3)4;/h1H3,(H,3,4);/q;+1/p-1 |
Propriétés de l’acétate de potassium
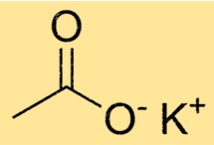
Formule d’acétate de potassium
La formule chimique de l’acétate de potassium est C2H3KO2. Il se compose d’un ion K+ et d’un ion CH3COO-. L’ion acétate est polyatomique, ce qui signifie qu’il est constitué de plusieurs atomes liés entre eux. Dans le cas de l’acétate, il est constitué de deux atomes de carbone, trois atomes d’hydrogène et deux atomes d’oxygène.
Acétate De Potassium Masse molaire
C2H3KO2 a une masse molaire de 98,14 g/mol. La masse molaire est la masse d’une mole d’une substance et est calculée en additionnant les masses atomiques de tous les atomes d’une molécule. Dans le cas du C2H3KO2, les masses atomiques de potassium, de carbone, d’hydrogène et d’oxygène sont additionnées pour arriver à la masse molaire.
Point d’ébullition de l’acétate de potassium
Le point d’ébullition du C2H3KO2 est de 881 °C (1618 °F). Le point d’ébullition est la température à laquelle une substance passe de l’état liquide à l’état gazeux. C2H3KO2 a un point d’ébullition relativement élevé par rapport à d’autres composés, ce qui peut être attribué à sa nature ionique et à la forte attraction entre les ions potassium chargés positivement et les ions acétate chargés négativement.
Acétate de potassium Point de fusion
Le point de fusion du C2H3KO2 est de 292 °C (558 °F). Le point de fusion est la température à laquelle un solide se transforme en liquide. C2H3KO2 a un point de fusion relativement élevé, qui peut être attribué à sa nature ionique et à la forte attraction entre les ions potassium chargés positivement et les ions acétate chargés négativement.
Densité d’acétate de potassium g/mL
La densité du C2H3KO2 est de 1,57 g/mL. La densité est la masse par unité de volume d’une substance. La densité relativement élevée de C2H3KO2 peut être attribuée à sa nature ionique et à la disposition compacte des ions dans son réseau cristallin.
Acétate De Potassium Poids moléculaire
Le poids moléculaire de C2H3KO2 est de 98,14 g/mol. Le poids moléculaire est la somme des poids atomiques de tous les atomes d’une molécule. Dans le cas de C2H3KO2, c’est la somme des poids atomiques du potassium, du carbone, de l’hydrogène et de l’oxygène.
Structure de l’acétate de potassium
C2H3KO2 a une structure cristalline ionique. Il se compose d’ions K+ chargés positivement et d’ions CH3COO- chargés négativement. Les ions acétate sont disposés dans un plan, chaque atome de carbone étant lié à un atome d’oxygène et à un atome d’hydrogène. Les ions potassium sont situés entre les plans des ions acétate, formant un réseau cristallin tridimensionnel.
| Apparence | Poudre cristalline blanche |
| Densité spécifique | 1,57 g/cm3 |
| Couleur | Incolore |
| Odeur | Inodore |
| Masse molaire | 98,14 g/mole |
| Densité | 1,57 g/ml |
| Point de fusion | 292 °C (558 °F) |
| Point d’ébullition | 881 °C (1618 °F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Très soluble dans l’eau |
| Solubilité | Soluble dans l’éthanol et le méthanol |
| La pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | 4,76 |
| pH | 7 (solution aqueuse à 10 %) |
Sécurité et dangers de l’acétate de potassium
Le C2H3KO2 est généralement considéré comme sans danger pour l’usage humain, avec une faible toxicité et aucun effet cancérigène ou mutagène connu. Cependant, il peut provoquer une irritation de la peau et des yeux, et une exposition prolongée ou répétée peut provoquer une dermatite. C’est également un léger irritant pour les voies respiratoires et peut provoquer de la toux ou un essoufflement s’il est inhalé en grande quantité. Lorsqu’il est ingéré, il peut provoquer une irritation gastro-intestinale, des nausées et des vomissements. De plus, le C2H3KO2 peut réagir avec certains produits chimiques pour produire des sous-produits dangereux, tels que l’acide acétique ou l’hydroxyde de potassium. Il doit donc être manipulé avec précaution et stocké de manière appropriée pour éviter tout contact avec des substances incompatibles.
| Symboles de danger | Aucun |
| Description de la sécurité | Tenir à l’écart de la chaleur, des étincelles et des flammes. Évitez l’ingestion, l’inhalation et le contact avec la peau et les yeux. Portez des gants et des lunettes de protection. |
| ID ONU | UN2923 |
| Code SH | 2915.29.10 |
| Classe de danger | 8 |
| Groupe d’emballage | III |
| Toxicité | Faible toxicité. Peut irriter la peau, les yeux et les voies respiratoires. L’ingestion peut provoquer une irritation gastro-intestinale, des nausées et des vomissements. |
Méthodes de synthèse de l’acétate de potassium
Pour synthétiser C2H3KO2, il faut neutraliser l’hydroxyde de potassium avec de l’acide acétique , faire réagir le carbonate de potassium avec l’acide acétique ou faire réagir le potassium métallique avec l’acide acétique.
Dans la méthode de neutralisation, on ajoute lentement de l’acide acétique à une solution d’ hydroxyde de potassium jusqu’à ce que le pH atteigne un niveau neutre. Ce processus conduit à la formation de C2H3KO2 et d’eau. Ensuite, l’expérimentateur évapore la solution résultante et obtient un solide cristallin blanc de C2H3KO2.
Dans cette méthode, le processus nécessite de chauffer complètement un mélange d’ acide acétique et de carbonate de potassium . Après cela, filtrez le mélange pour éliminer les solides restants, puis évaporez et cristallisez pour obtenir C2H3KO2.
La réaction du potassium métallique avec l’acide acétique est une autre méthode de synthèse du C2H3KO2. Le processus consiste à ajouter du potassium métallique à une solution d’acide acétique, qui produit du C2H3KO2 et de l’hydrogène gazeux. Ensuite, évaporer la solution et cristalliser le C2H3KO2 permet son extraction.
Utilisations de l’acétate de potassium
Le C2H3KO2 a un large éventail d’utilisations dans diverses industries, notamment :
Agent de dégivrage : Couramment utilisé comme agent de dégivrage sur les pistes d’aéroport, les ponts et autres surfaces où les dégivrants traditionnels à base de sel peuvent nuire à l’environnement.
Conservateur alimentaire : utilisé comme conservateur alimentaire pour éviter la détérioration et prolonger la durée de conservation de certains aliments.
Agent tampon : utilisé comme agent tampon dans diverses industries, notamment les produits pharmaceutiques, textiles et cosmétiques.
Catalyseur : Utilisé comme catalyseur dans la production de certains produits chimiques, comme l’anhydride acétique.
Réactif de laboratoire : réactif courant en laboratoire à diverses fins d’analyse et de recherche.
Additif alimentaire pour animaux : utilisé comme additif alimentaire pour le bétail, en particulier dans les régimes alimentaires des volailles et des porcs, pour améliorer la croissance et la santé globale.
Ignifuge : Utilisé comme ignifuge dans certains plastiques et textiles pour réduire le risque d’incendie.
Applications médicales : Également utilisé dans certaines applications médicales, telles que le traitement de l’hypokaliémie (faibles niveaux de potassium) et comme composant dans certaines solutions de dialyse.
Des questions:
Q : L’acétate de potassium est-il soluble ?
R : Oui, C2H3KO2 est soluble dans l’eau.
Q : Quelle est la formule de l’acétate de potassium ?
R : La formule de l’acétate de potassium est CH3CO2K.
Q : À quoi sert l’acétate de potassium ?
R : C2H3KO2 est utilisé à diverses fins, notamment comme agent de dégivrage, conservateur alimentaire, agent tampon, catalyseur, réactif de laboratoire, additif pour l’alimentation animale, ignifuge et dans certaines applications médicales.
Q : L’acétate de potassium est-il soluble dans l’eau ?
R : Oui, C2H3KO2 est soluble dans l’eau.
Q : L’acétate de potassium est-il un acide ou une base ?
R : C2H3KO2 n’est ni un acide ni une base, mais il peut agir comme agent tampon pour aider à maintenir un pH stable dans les solutions.
