L’acétate de plomb (Pb(OAc)₂) est un composé cristallin blanc. Il est utilisé dans les teintures capillaires en raison de sa capacité à assombrir les cheveux. Cependant, il présente des risques pour la santé et doit être manipulé avec précaution.
| Nom UICPA | Acétate de plomb (II) |
| Formule moléculaire | Pb(OAc)₂ |
| Numero CAS | 301-04-2 |
| Synonymes | Éthanoate de plomb (II), acétate de plomb, diacétate de plomb |
| InChI | InChI=1S/2C2H4O2.Pb/c2 1-2(3)4;/h2 1H3,(H,3,4);/q;;+2/p-2 |
Propriétés de l’acétate de plomb
Formule d’acétate de plomb
La formule chimique du diacétate de plomb est Pb(OAc)₂, où Pb représente le symbole du plomb et OAc désigne l’ion CH₃COO⁻. C’est un composé cristallin blanc avec deux ions CH₃COO⁻ par atome de plomb.
Acétate De Plomb Masse molaire
Le diacétate de plomb a une masse molaire d’environ 325,29 g/mol. Pour calculer cela, nous additionnons les masses atomiques d’un atome de Pb et de deux ions CH₃COO⁻ présents dans sa formule chimique.
Point d’ébullition de l’acétate de plomb
Le point d’ébullition du diacétate de plomb est d’environ 280°C (536°F). Lorsqu’il est exposé à des températures élevées, il subit une transition de phase de l’état solide à l’état liquide, ce qui rend crucial sa manipulation avec prudence.
Acétate de plomb Point de fusion
Le diacétate de plomb a un point de fusion d’environ 280°C (536°F). À cette température, le composé solide se transforme en liquide, ce qui le rend adapté à certaines applications comme les teintures capillaires.
Densité de l’acétate de plomb g/mL
La densité du diacétate de plomb est d’environ 3,25 g/mL. Cette valeur représente la masse du composé par unité de volume et est importante pour comprendre ses propriétés physiques et ses applications.
Acétate De Plomb Poids moléculaire
Le poids moléculaire du diacétate de plomb est d’environ 325,29 g/mol. Il fournit des informations essentielles pour divers calculs chimiques et aide les chercheurs à comprendre son comportement et sa réactivité.
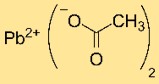
Structure en acétate de plomb
Le diacétate de plomb a une structure cristalline avec des cations Pb²⁺ coordonnés à deux ions CH₃COO⁻. La disposition des atomes et des liaisons dans le réseau cristallin détermine sa stabilité et ses propriétés.
Solubilité de l’acétate de plomb
Le diacétate de plomb est peu soluble dans l’eau. Il se dissout dans une certaine mesure pour former une solution claire et incolore. Sa solubilité varie en fonction de la température, ce qui rend crucial son stockage et sa manipulation appropriée pour éviter toute contamination de l’environnement.
| Apparence | Cristallin blanc |
| Gravité spécifique | ~3,25 g/mL |
| Couleur | Incolore |
| Odeur | Inodore |
| Masse molaire | ~325,29 g/mole |
| Densité | ~3,25 g/mL |
| Point de fusion | ~280°C (536°F) |
| Point d’ébullition | ~280°C (536°F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Peu soluble |
| Solubilité | Solubilité limitée, varie en fonction de la température |
| Pression de vapeur | Négligeable |
| Densité de vapeur | Pas disponible |
| pKa | Pas disponible |
| pH | Pas disponible |
Sécurité et dangers liés à l’acétate de plomb
Le diacétate de plomb présente des risques importants pour la sécurité et doit être manipulé avec le plus grand soin. Il est toxique s’il est ingéré, inhalé ou absorbé par la peau. Une exposition prolongée peut entraîner un empoisonnement au plomb, entraînant des effets néfastes sur la santé, notamment sur le système nerveux et les reins. Evitez le contact avec les yeux, la peau et les vêtements. Utiliser une ventilation adéquate et un équipement de protection individuelle lors de la manipulation. Empêchez son rejet dans l’environnement car il peut contaminer le sol et l’eau, ayant un impact sur les écosystèmes. Gardez-le hors de portée des enfants et des animaux. Éliminez-le correctement conformément aux réglementations locales. Dans l’ensemble, le strict respect des consignes de sécurité est crucial pour minimiser les risques.
| Symboles de danger | Risque pour la santé, risque pour l’environnement |
| Description de la sécurité | Toxique et nocif pour l’environnement |
| Numéros d’identification de l’ONU | UN1616 |
| Code SH | 29152900 |
| Classe de danger | 6.1 (Substances toxiques) |
| Groupe d’emballage | II |
| Toxicité | Très toxique |
Méthodes de synthèse de l’acétate de plomb
Il existe plusieurs méthodes pour synthétiser le diacétate de plomb.
Une approche courante consiste à faire réagir le plomb métallique avec de l’acide acétique . Dans cette méthode, vous ajoutez généralement du plomb dans un récipient et versez lentement de l’acide acétique dans le récipient tout en contrôlant les conditions telles que l’agitation et la régulation de la température. La réaction se déroule, formant du diacétate de plomb sous forme de précipité blanc.
Une autre méthode implique la réaction de l’oxyde de plomb (PbO) ou du carbonate de plomb (PbCO₃) avec de l’acide acétique glacial. Vous mélangez de l’oxyde de plomb ou du carbonate de plomb avec de l’acide acétique et chauffez le mélange, provoquant une réaction qui donne du diacétate de plomb.
Une autre voie de synthèse consiste à effectuer la réaction de double déplacement de Pb(NO₃)₂ avec CH3COONa dans une solution aqueuse. Cette réaction produit du diacétate de plomb sous forme de précipité.
Il est essentiel de manipuler ces méthodes de synthèse avec prudence en raison de la toxicité des composés du plomb. Vous devez suivre les mesures de sécurité appropriées et mener les processus dans des zones bien ventilées avec un équipement de protection approprié. En outre, le respect des réglementations en matière d’élimination des déchets est crucial pour prévenir la contamination de l’environnement.
Utilisations de l’acétate de plomb
Le diacétate de plomb trouve diverses applications en raison de ses propriétés uniques. Voici quelques utilisations :
- Teinture capillaire : Certaines teintures capillaires utilisent du diacétate de plomb pour assombrir progressivement les cheveux au fil du temps. Cependant, en raison de sa toxicité, son utilisation dans les produits cosmétiques a été restreinte dans de nombreux pays.
- Réactif de laboratoire : Il sert de réactif dans les laboratoires pour diverses réactions chimiques et analyses.
- Photographie : dans le passé, les photographes utilisaient du diacétate de plomb pour sensibiliser les films et papiers photographiques lors de la photographie en noir et blanc.
- Sucre de plomb : Historiquement, les gens utilisaient du diacétate de plomb, connu sous le nom de « sucre de plomb », pour conserver le vin et d’autres boissons.
- Chimie analytique : En chimie analytique, les scientifiques utilisent le diacétate de plomb pour détecter la présence de sulfure d’hydrogène gazeux.
- Mordant en teinture : Il agit comme mordant dans la teinture et l’impression des textiles.
- Synthèse chimique : Il sert de précurseur à la synthèse d’autres composés plombés.
Malgré ses diverses utilisations, il est indispensable d’être prudent avec le diacétate de plomb en raison de sa forte toxicité. Minimisez l’exposition aux composés de plomb et suivez strictement les mesures de sécurité appropriées lors de leur manipulation et de leur élimination afin de protéger la santé humaine et l’environnement. Limitez ou remplacez bon nombre de ses applications par des alternatives plus sûres.
Des questions:
Q : L’acétate de plomb II est-il soluble dans l’eau ?
R : Le diacétate de plomb II est peu soluble dans l’eau.
Q : L’acétate de plomb est-il soluble ?
R : Le diacétate de plomb est peu soluble dans l’eau.
Q : Quelles teintures capillaires contiennent de l’acétate de plomb ?
R : Dans certains pays, certaines teintures capillaires progressives contiennent du diacétate de plomb comme ingrédient, bien que son utilisation soit restreinte en raison de problèmes de toxicité.
Q : Une exposition chronique à l’acide acétique peut entraîner quels troubles ?
R : Une exposition chronique à l’acide acétique peut provoquer une irritation respiratoire et cutanée.
Q : Quelle est la formule du diacétate de plomb II ?
R : La formule du diacétate de plomb II est Pb(OAc)₂.
Q : Quel acétate de plomb est utilisé dans le catalyseur Lindlar ?
R : Le diacétate de plomb (II) n’est généralement pas utilisé dans le catalyseur Lindlar ; à la place, de l’acétate de palladium est utilisé.
Q : Qu’est-ce que l’acétate de plomb ?
R : Le diacétate de plomb est un composé cristallin blanc utilisé dans diverses applications, telles que les teintures capillaires et la synthèse chimique.
Q : Comment fabriquer de l’acétate de plomb ?
R : Le diacétate de plomb peut être préparé en faisant réagir du plomb métallique avec de l’acide acétique ou par d’autres méthodes de synthèse chimique.
Q : Existe-t-il des teintures capillaires sans acétate de plomb ?
R : Oui, de nombreuses teintures capillaires modernes ne contiennent pas de diacétate de plomb, car son utilisation dans les produits cosmétiques a été restreinte dans de nombreux pays en raison de sa toxicité.
Q : Une réaction se produit-elle lorsque des solutions aqueuses d’iodure d’aluminium et d’acétate de plomb (II) sont combinées ?
R : Oui, une réaction se produit et du PbI2 et de l’acétate d’aluminium se forment sous forme de produits.
Q : Le chromate de sodium et l’acétate de plomb (II) réagissent-ils ?
R : Oui, une réaction se produit, entraînant la formation de PbCrO4 et d’acétate de sodium.
Q : Quel produit chimique réagit avec le sulfate de cuivre (II) pour produire du bleu et avec l’acétate de plomb (II) pour produire du blanc ?
R : L’hydroxyde d’ammonium réagit avec le sulfate de cuivre (II) pour former des précipités bleus (hydroxyde de cuivre). En revanche, le sulfure d’hydrogène réagit avec le diacétate de plomb (II) pour créer du sulfure de céruse.
