L’acétate de nickel, de formule Ni(CH3COO)2, est un composé chimique. Il est utilisé dans diverses industries, notamment la galvanoplastie et la synthèse de catalyseurs, en raison de ses composants en nickel et en acétate.
| Nom UICPA | Acétate de Nickel |
| Formule moléculaire | Ni(CH3COO)2 |
| Numero CAS | 373-02-4 |
| Synonymes | Sel de nickel de l’acide acétique, diacétate de nickel, acétate de nickel |
| InChI | InChI=1S/2C2H4O2.Ni/c2 1-2(3)4;/h2 1H3,(H,3,4);/q;;+2/p-2 |
Propriétés de l’acétate de nickel
Formule d’acétate de nickel
La formule chimique du diacétate de nickel est Ni(CH3COO)2. Cela signifie que chaque molécule de diacétate de nickel contient un atome de Ni lié à deux ions CH3COO.
Acétate De Nickel Masse molaire
La masse molaire du diacétate de nickel est d’environ 176,7 g/mol. Cette valeur est calculée en additionnant les masses atomiques d’un atome de nickel et de quatre atomes d’oxygène provenant des ions acétate.
Point d’ébullition de l’acétate de nickel
Le diacétate de nickel a un point d’ébullition d’environ 140°C (284°F). A cette température, le composé passe de son état liquide à un état gazeux.
Point de fusion de l’acétate de nickel
Le point de fusion du diacétate de nickel est d’environ 140°C (284°F). C’est la température à laquelle le composé solide se transforme en liquide.
Densité de l’acétate de nickel g/mL
Le diacétate de nickel a une densité d’environ 1,744 g/mL. Cette valeur de densité représente la masse du composé par unité de volume et est couramment utilisée pour caractériser les liquides.
Acétate De Nickel Poids moléculaire
Le poids moléculaire du diacétate de nickel, également appelé masse moléculaire, est de 176,7 g/mol. Cette valeur est calculée en additionnant les poids atomiques de tous les atomes du composé.
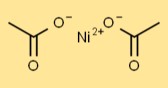
Structure en acétate de nickel
La structure du diacétate de nickel implique un atome central de Ni lié à deux ions CH3COO. Les ions acétate contribuent à la coordination autour de l’atome de nickel, lui conférant une géométrie spécifique.
Solubilité de l’acétate de nickel
Le diacétate de nickel présente une solubilité modérée dans l’eau. Il peut se dissoudre dans l’eau pour former une solution. La solubilité peut varier en fonction de la température et de la présence d’autres substances dans la solution.
| Apparence | Poudre cristalline verte |
| Gravité spécifique | ~1,744 g/mL |
| Couleur | Vert |
| Odeur | Inodore |
| Masse molaire | ~176,7 g/mole |
| Densité | ~1,744 g/mL |
| Point de fusion | ~140°C (284°F) |
| Point d’ébullition | ~140°C (284°F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Modéré |
| Solubilité | Soluble dans divers solvants |
| Pression de vapeur | Pas bien documenté |
| Densité de vapeur | Pas bien documenté |
| pKa | Pas bien documenté |
| pH | Pas bien documenté |
Sécurité et dangers de l’acétate de nickel
Le diacétate de nickel présente des risques potentiels pour la sécurité. Il peut irriter la peau, les yeux et les voies respiratoires par contact ou par inhalation. Évitez l’ingestion car cela pourrait entraîner des effets nocifs. Une ventilation adéquate est nécessaire pour éviter l’inhalation de ses fumées. Lors de la manipulation, portez un équipement de protection approprié comme des gants et des lunettes. Éliminez-le de manière appropriée et évitez son rejet dans l’environnement. En cas d’exposition, consulter un médecin. Suivez les fiches de données de sécurité et les directives lors de l’utilisation du diacétate de nickel pour minimiser les risques associés à sa manipulation, son stockage et son élimination.
| Symboles de danger | Danger pour la santé |
| Description de la sécurité | Provoque une irritation de la peau et des yeux. Nocif en cas d’ingestion ou d’inhalation. Eviter le rejet dans l’environnement. Portez un équipement de protection. Consulter un médecin en cas d’exposition. |
| Numéros d’identification de l’ONU | UN3077 (Classe 9) |
| Code SH | 2915.12.00 |
| Classe de danger | 9 (Marchandises dangereuses diverses) |
| Groupe d’emballage | III |
| Toxicité | Toxicité modérée ; peut provoquer une irritation et des dommages en cas d’ingestion, d’inhalation ou de contact avec la peau ou les yeux. |
Méthodes de synthèse de l’acétate de nickel
Le diacétate de nickel peut être synthétisé par diverses méthodes. Une approche courante consiste à faire réagir de l’oxyde de nickel (NiO) ou du carbonate de nickel (NiCO3) avec de l’acide acétique (CH3COOH) ou ses dérivés. Cette réaction se produit dans des conditions contrôlées, entraînant la formation de diacétate de nickel et d’eau comme sous-produits. Une autre méthode consiste à traiter le nickel métallique ou l’hydroxyde de nickel (Ni(OH)2) avec de l’acide acétique ou ses sels, facilitant la création de diacétate de nickel.
De plus, un procédé de précipitation peut être utilisé en mélangeant un sel de nickel soluble, tel que le chlorure de nickel (NiCl2), avec un sel d’acétate soluble. Ce mélange provoque la précipitation du diacétate de nickel hors de la solution, qui peut ensuite être séparé et collecté. Un ajustement minutieux du pH au cours de ce processus contribue à obtenir des résultats optimaux.
Ces méthodes de synthèse sont essentielles à la production de diacétate de nickel pour diverses applications, notamment son utilisation comme catalyseur et précurseur dans des réactions chimiques. Le choix de la méthode dépend de facteurs tels que la pureté souhaitée, l’efficacité et l’échelle de production.
Utilisations de l’acétate de nickel
Le diacétate de nickel trouve des applications polyvalentes dans plusieurs industries en raison de ses propriétés distinctes et de sa composition chimique. Certaines utilisations importantes incluent :
- Galvanoplastie : Le diacétate de nickel sert de source d’ions nickel dans les processus de galvanoplastie. Il facilite le dépôt d’une fine couche de nickel sur divers substrats, améliorant ainsi la résistance à la corrosion et offrant une finition décorative.
- Synthèse de catalyseurs : les chimistes l’utilisent comme précurseur pour créer des catalyseurs pour de multiples réactions chimiques. Des industries comme la pétrochimie et la pharmacie dépendent fortement des catalyseurs contenant du nickel.
- Industrie textile : dans les processus de teinture des textiles, il aide à fixer les colorants sur les fibres du tissu, à améliorer l’adhérence des colorants et la solidité des couleurs.
- Réactif de laboratoire : Les scientifiques utilisent le diacétate de nickel comme réactif pour détecter et identifier certains composés, leur permettant ainsi de tester des groupes fonctionnels spécifiques.
- Traitement de surface : les fabricants l’appliquent dans des applications de traitement de surface, telles que la production de cartes de circuits imprimés. Il aide à former une couche protectrice sur les surfaces en cuivre.
- Synthèse organique : Dans diverses réactions de synthèse organique, le diacétate de nickel joue un rôle crucial dans la formation des liaisons carbone-carbone et carbone-hétéroatome.
- Purification des gaz : il joue un rôle clé dans les processus de purification des gaz, en particulier dans l’élimination des impuretés comme le sulfure d’hydrogène des gaz industriels.
- Chimie analytique : le diacétate de nickel est un réactif standard en chimie analytique, servant à des fins d’étalonnage et de contrôle qualité.
Dans l’ensemble, les diverses applications du diacétate de nickel mettent en évidence son importance dans tous les secteurs, de l’amélioration de l’esthétique des produits à l’aide aux transformations et processus chimiques critiques.
Des questions:
Q : Pouvez-vous mélanger de l’acétal et du nickel dans une seule boucle ?
R : Le mélange d’acétal et de nickel dans une boucle n’est généralement pas recommandé, car l’acétal peut réagir avec certains métaux, provoquant potentiellement de la corrosion et des dommages aux composants de la boucle.
Q : Quelle est la formule correcte pour le composé ionique acétate de nickel ?
R : La formule correcte pour le diacétate de nickel, un composé ionique, est Ni(CH3COO)2.
Q : L’acétate de nickel (ii) + le bromure de fer (ii) ont-ils une formule empirique ?
R : Le diacétate de nickel (II) et le bromure de fer (II) ne forment pas un composé direct, une formule empirique n’est donc pas applicable.
Q : Qu’est-ce qu’un waterblock en acétal-nickel ?
R : Un waterblock en acétal-nickel fait référence à un composant de refroidissement utilisé dans les systèmes de refroidissement liquide pour PC, généralement fabriqué en plastique acétal et présentant une surface nickelée.
Q : Quelles sont les vitesses de réaction du nickel et du cuivre avec l’acide acétique ?
R : Le nickel et le cuivre réagissent lentement avec l’acide acétique, libérant de l’hydrogène gazeux et formant leurs sels diacétates respectifs.
Q : Comment peut-on fabriquer de l’acétate de nickel ?
R : Le diacétate de nickel peut être fabriqué en faisant réagir de l’oxyde de nickel ou du carbonate de nickel avec de l’acide acétique, suivi d’une cristallisation et d’une purification.
Q : Comment éliminer l’acétate de nickel ?
R : Éliminez le diacétate de nickel comme déchet dangereux, conformément aux réglementations locales. Il est important de consulter les autorités de gestion des déchets pour connaître les méthodes d’élimination appropriées.
Q : Quelle est la formule de l’acétate de nickel(ii) ?
R : La formule du diacétate de nickel(II) est Ni(CH3COO)2.
Q : L’acétate de nickel est-il soluble ?
R : Oui, le diacétate de nickel est modérément soluble dans l’eau, formant une solution qui peut être utilisée dans diverses applications.
