L’acétate de magnésium (Mg(C2H3O2)2) est un composé composé d’ions Mg2+ et C2H3O2-. Il est couramment utilisé comme agent de séchage en synthèse organique et comme additif alimentaire.
| Nom UICPA | Acétate de magnésium |
| Formule moléculaire | Mg(C2H3O2)2 |
| Numero CAS | 142-72-3 |
| Synonymes | Diacétate de magnésium, sel de magnésium d’acide acétique, éthanoate de magnésium, CAS 73567-85-6, EINECS 240-882-6, UNII-RS92S4G29A |
| InChI | InChI=1S/2C2H4O2.Mg/c2 1-2(3)4;/h2 1H3,(H,3,4);/q;;+2/p-2 |
Propriétés de l’acétate de magnésium
Formule d’acétate de magnésium
La formule chimique de l’acétate de magnésium est Mg(C2H3O2)2. Cette formule représente la composition du composé, avec un ion Mg2+ et deux C2H3O2-. La formule est importante pour déterminer la quantité de composé nécessaire pour une réaction particulière. Il est également utile pour identifier le composé dans différents contextes.
Acétate De Magnésium Masse molaire
La masse molaire de Mg(C2H3O2)2 est 142,39 g/mol. Cette valeur est obtenue en additionnant les masses atomiques des ions Mg2+ (24,31 g/mol) et C2H3O2- (58,08 g/mol). La masse molaire est une propriété importante pour déterminer la quantité de Mg(C2H3O2)2 nécessaire à une réaction particulière.
Point d’ébullition de l’acétate de magnésium
Le Mg(C2H3O2)2 a un point d’ébullition relativement élevé de 117,5°C (243,5°F). Cette propriété est due à la nature ionique du composé et à la forte attraction électrostatique entre les ions magnésium et acétate. À cette température, le composé commencera à se vaporiser, mais il restera à l’état liquide à moins d’être soumis à des températures plus élevées.
Acétate de magnésium Point de fusion
Le point de fusion du Mg(C2H3O2)2 est de 160°C (320°F). Cette valeur est obtenue en chauffant le composé jusqu’à ce qu’il passe d’un solide à un liquide. Le point de fusion est une propriété importante qui détermine la température à laquelle le composé passera de l’état solide à l’état liquide. Cette propriété est essentielle pour la manipulation et le stockage appropriés du composé.
Densité d’acétate de magnésium g/mL
La densité de Mg(C2H3O2)2 est de 1,45 g/mL. Cette valeur est obtenue en divisant la masse du composé par son volume. La densité est une propriété importante qui détermine la masse d’un volume particulier du composé. C’est également une propriété utile pour déterminer la pureté du composé, car les impuretés peuvent affecter la densité.
Acétate De Magnésium Poids moléculaire
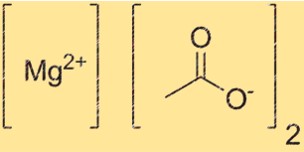
Le poids moléculaire du Mg(C2H3O2)2 est de 142,39 g/mol. Cette valeur est obtenue en additionnant les masses atomiques du magnésium et de deux ions acétate. Le poids moléculaire est une propriété importante qui détermine la quantité d’un composé nécessaire pour une réaction particulière. Il est également utile pour déterminer la pureté du composé.
Structure de l’acétate de magnésium
Mg(C2H3O2)2 a une structure ionique dans laquelle les cations Mg2+ sont entourés de deux anions C2H3O2. Le cation Mg2+ a une charge de +2, tandis que l’anion C2H3O2- a une charge de -1. La structure est maintenue ensemble par attraction électrostatique entre les ions de charges opposées.
| Apparence | Solide cristallin blanc |
| Gravité spécifique | 1,45 g/ml |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 142,39 g/mole |
| Densité | 1,45 g/ml |
| Point de fusion | 160°C (320°F) |
| Point d’ébullition | 117,5°C (243,5°F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Très soluble |
| Solubilité | Soluble dans l’éthanol, le méthanol, l’acétone |
| Pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | 4,76 |
| pH | 7,5 – 9,0 |
Sécurité et dangers de l’acétate de magnésium
Le Mg(C2H3O2)2 est généralement considéré comme sûr pour une utilisation dans les applications prévues, mais comme pour tout composé chimique, il existe certains dangers potentiels dont il faut être conscient. Il peut irriter la peau, les yeux et le système respiratoire en cas d’inhalation ou d’ingestion. Une exposition prolongée ou répétée peut entraîner des effets plus graves sur la santé. Le Mg(C2H3O2)2 doit être manipulé avec précaution et des mesures de protection appropriées doivent être prises lors de la manipulation de ce composé. Il est également important de suivre des protocoles appropriés de stockage et d’élimination pour éviter une exposition accidentelle ou des dommages environnementaux.
| Symboles de danger | Aucun |
| Description de la sécurité | S22 – Ne pas respirer les poussières ; S24/25 – Éviter tout contact avec la peau et les yeux ; S36/37/39 – Porter des vêtements de protection appropriés, des gants et une protection des yeux/du visage ; S45 – En cas d’accident ou de malaise, consulter immédiatement un médecin (si possible lui montrer l’étiquette) |
| Numéros d’identification de l’ONU | N’est pas applicable |
| Code SH | 29152900 |
| Classe de danger | Non classé comme dangereux |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | Faible toxicité, mais peut irriter la peau, les yeux et le système respiratoire s’il n’est pas manipulé correctement |
Méthodes de synthèse de l’acétate de magnésium
Synthétisez Mg(C2H3O2)2 en utilisant diverses méthodes, notamment la réaction de l’oxyde de magnésium ou de l’hydroxyde de magnésium avec de l’acide acétique .
Dans une méthode courante, ajoutez de l’oxyde de magnésium à une solution d’ acide acétique pour former du Mg(C2H3O2)2 et de l’eau. Filtrez la solution obtenue et évaporez-la pour obtenir un produit solide Mg(C2H3O2)2.
Une autre méthode implique la réaction du magnésium métallique avec l’acide acétique en présence d’un catalyseur, tel que le chlorure de cuivre ou le sulfate de cuivre. La réaction produit du Mg(C2H3O2)2, de l’hydrogène gazeux et du cuivre métallique comme sous-produit.
Synthétisez Mg(C2H3O2)2 par une réaction de métathèse en faisant réagir du chlorure de magnésium avec de l’acétate de sodium en présence d’eau pour produire du Mg(C2H3O2)2 et du chlorure de sodium.
Dans l’ensemble, le choix de la méthode de synthèse dépend de facteurs tels que la pureté souhaitée du produit Mg(C2H3O2)2, la disponibilité des matières premières et l’échelle du processus de production.
Utilisations de l’acétate de magnésium
Le Mg(C2H3O2)2 a un large éventail d’applications dans diverses industries en raison de ses propriétés uniques. Voici quelques utilisations courantes du Mg(C2H3O2)2 :
- Additifs alimentaires : Utilisés comme additifs alimentaires pour améliorer la valeur nutritionnelle des aliments et prévenir leur détérioration.
- Médecine : Utilisé en médecine comme source de magnésium, un minéral essentiel qui joue un rôle clé dans de nombreux processus physiologiques.
- Textiles : Utilisé dans l’industrie textile comme mordant, substance qui aide à fixer les colorants sur les tissus.
- Traitement de l’eau : utilisé dans les applications de traitement de l’eau pour éliminer les impuretés de l’eau et empêcher l’accumulation de tartre dans les tuyaux et les équipements.
- Béton : Utilisé dans la production de béton pour améliorer sa résistance et sa durabilité.
- Synthèse chimique : utilisé comme matière première pour la synthèse d’autres composés chimiques, tels que des produits pharmaceutiques, des arômes et des parfums.
Des questions:
Q : Que se forme lorsque l’acide acétique et le carbonate de magnésium réagissent ?
R : Lorsque l’acide acétique et le carbonate de magnésium réagissent, du Mg(C2H3O2)2, du dioxyde de carbone et de l’eau se forment.
Q : Où acheter de l’acétate de calcium et de magnésium ?
R : Le calcium Mg(C2H3O2)2 peut être acheté auprès de divers fournisseurs de produits chimiques et sur les marchés en ligne.
Q : L’acétate de magnésium est-il soluble dans l’eau ?
R : Oui, Mg(C2H3O2)2 est soluble dans l’eau, avec une solubilité d’environ 54 g/L à température ambiante.
Q : Quelle est la concentration molaire d’une solution de 5,00 L contenant 0,800 mole d’acétate de magnésium ?
R : La concentration molaire d’une solution de 5,00 L contenant 0,800 mole de Mg(C2H3O2)2 est de 0,160 M.
