L’acétate de cuivre (Cu(CH3COO)2) est un composé cristallin bleu-vert. Il se forme lorsque le cuivre réagit avec l’acide acétique. Il trouve des applications dans diverses industries, comme celles des catalyseurs et des fongicides.
| Nom UICPA | Acétate de cuivre(II) |
| Formule moléculaire | Cu(CH3COO)2 |
| Numero CAS | 142-71-2 |
| Synonymes | Acétate cuivrique, sel de cuivre de l’acide acétique, diacétate de cuivre |
| InChI | InChI=1S/2C2H4O2.Cu/c2 1-2(3)4;/h2 1H3,(H,3,4);/q;;+2/p-2 |
Propriétés de l’acétate de cuivre
Formule d’acétate de cuivre
L’acétate cuivrique a la formule chimique Cu(CH3COO)2. Il se compose d’un atome de cuivre (Cu) lié à deux groupes acétate (CH3COO). La formule représente le rapport des éléments dans le composé.
Acétate De Cuivre Masse molaire
La masse molaire de l’acétate cuivrique peut être calculée en additionnant les masses atomiques de ses éléments constitutifs. Le cuivre (Cu) a une masse molaire de 63,55 g/mol, tandis que l’acétate (CH3COO) a une masse molaire de 59,04 g/mol. Ainsi, la masse molaire de l’acétate cuivrique est de 181,63 g/mol.
Point d’ébullition de l’acétate de cuivre
L’acétate cuivrique se décompose avant d’atteindre le point d’ébullition en raison de son instabilité thermique. Son point d’ébullition n’est donc pas bien défini. Au lieu de cela, il subit une décomposition lorsqu’il est chauffé de manière significative.
Point de fusion de l’acétate de cuivre
L’acétate cuivrique fond généralement entre 115 °C et 120 °C (239 °F et 248 °F). Le point de fusion peut varier légèrement en fonction de la pureté du composé.
Densité d’acétate de cuivre g/mL
La densité de l’acétate cuivrique est d’environ 1,882 g/mL. Cette valeur correspond à la masse d’acétate cuivrique par unité de volume. La densité peut varier en fonction des changements de température et de pression.
Acétate De Cuivre Poids moléculaire
Le poids moléculaire de l’acétate cuivrique, calculé à partir de sa formule, est de 181,63 g/mol. Il représente la somme des poids atomiques de tous les atomes présents dans une molécule d’acétate cuivrique.
Structure en acétate de cuivre
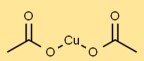
L’acétate cuivrique a une structure de réseau cristallin sous sa forme solide. Les atomes de cuivre sont coordonnés avec des groupes acétate, formant un arrangement stable. Il apparaît sous forme de cristaux bleu-vert en raison de sa géométrie de coordination.
Solubilité de l’acétate de cuivre
L’acétate cuivrique présente une solubilité modérée dans l’eau. Il peut se dissoudre dans les solvants polaires en raison de la présence d’ions acétate. Cependant, la solubilité peut être limitée et sa dissolution peut être influencée par la température et le pH.
| Apparence | Solide cristallin bleu-vert |
| Gravité spécifique | 1,882 g/mL |
| Couleur | Bleu vert |
| Odeur | Inodore |
| Masse molaire | 181,63 g/mole |
| Densité | 1,882 g/mL |
| Point de fusion | 115°C – 120°C (239°F – 248°F) |
| Point d’ébullition | Se décompose |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Solubilité modérée dans l’eau |
| Solubilité | Soluble dans les solvants polaires, légèrement soluble dans l’éther et le glycérol |
| La pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | Pas disponible |
| pH | Acide (environ 4-5) |
Sécurité et dangers de l’acétate de cuivre
L’acétate cuivrique pose certains problèmes de sécurité et dangers. Il est essentiel de le manipuler avec précaution et de suivre les protocoles de sécurité. Le contact direct avec le composé peut provoquer une irritation de la peau et des yeux. L’inhalation de ses poussières ou de ses vapeurs peut entraîner une gêne respiratoire. Évitez l’ingestion car cela peut être nocif. Gardez-le à l’écart des matériaux incompatibles et des sources de chaleur ou d’inflammation pour éviter tout risque d’incendie. En cas d’exposition accidentelle, rincez immédiatement les zones touchées et consultez un médecin. Conservez l’acétate de cuivre dans un endroit bien ventilé et sécurisé, loin des enfants et des personnes non autorisées. Utilisez toujours un équipement de protection individuelle approprié lorsque vous travaillez avec ce composé.
| Symboles de danger | Corrosif, Toxique Aigu, Irritant |
| Description de la sécurité | Évitez tout contact direct avec la peau et les yeux. Utiliser dans un endroit bien ventilé. Manipuler avec soin. |
| Numéros d’identification de l’ONU | Non attribué |
| Code SH | 29152900 |
| Classe de danger | 6.1 (Substances toxiques) |
| Groupe d’emballage | III (Faible danger) |
| Toxicité | Peut provoquer une irritation de la peau et des yeux. L’inhalation peut provoquer une gêne respiratoire. Évitez d’ingérer. |
Méthodes de synthèse de l’acétate de cuivre
Il existe plusieurs méthodes pour synthétiser l’acétate cuivrique.
Une approche courante implique la réaction entre l’oxyde de cuivre (CuO) ou l’hydroxyde de cuivre (Cu(OH)2) avec l’acide acétique (CH3COOH). Ils combinent et remuent les deux substances, ce qui conduit à la formation d’acétate cuivrique et d’eau. Une autre méthode est la réaction du carbonate de cuivre (CuCO3) avec l’acide acétique, produisant de l’acétate cuivrique, du dioxyde de carbone (CO2) et de l’eau.
Une méthode de synthèse alternative implique la réaction du cuivre métallique avec un mélange d’acide acétique et de peroxyde d’hydrogène (H2O2). Cette réaction conduit à la formation d’acétate cuivrique et d’eau. L’acétate cuivrique résulte de la réaction entre le sulfate de cuivre (II) (CuSO4) et l’acétate de calcium (Ca(CH3COO)2. Cette réaction donne de l’acétate cuivrique et du sulfate de calcium (CaSO4).
Le chauffage et le reflux d’un mélange de poudre de cuivre et d’acide acétique glacial produisent de l’acétate cuivrique. Ce processus conduit à la formation d’acétate cuivrique. La disponibilité des réactifs et la pureté souhaitée du produit final déterminent les avantages distincts de chaque méthode.
Utilisations de l’acétate de cuivre
L’acétate de cuivre trouve des applications polyvalentes dans diverses industries en raison de ses propriétés uniques. Voici quelques utilisations importantes :
- Catalyseur : L’acétate cuivrique catalyse de nombreuses réactions organiques, dont la synthèse de l’acétate de vinyle et de l’anhydride acétique.
- Galvanoplastie : L’acétate cuivrique facilite les processus de galvanoplastie, en conférant une fine couche de cuivre aux objets métalliques, améliorant ainsi leur apparence et leur résistance à la corrosion.
- Intermédiaires chimiques : Le composé joue un rôle crucial en tant qu’intermédiaire dans la production de divers produits chimiques comme l’oxyde de cuivre, le naphténate de cuivre et les savons de cuivre.
- Agent de préservation du bois : L’acétate de cuivre agit comme un agent de préservation du bois, protégeant le bois des attaques de champignons et d’insectes, couramment utilisé pour préserver les traverses de chemin de fer et les poteaux électriques.
- Fongicide : En agriculture, l’acétate de cuivre sert de fongicide pour lutter contre les maladies fongiques dans les cultures, en particulier dans les vignobles et les vergers.
- Pyrotechnie : L’acétate de cuivre trouve une application dans les formulations pyrotechniques, produisant des couleurs bleues et vertes vibrantes dans les feux d’artifice et les fusées éclairantes.
- Teinture textile : Il agit comme mordant dans les processus de teinture textile, facilitant la liaison des colorants aux fibres.
- Réactif de laboratoire : Le composé agit comme un réactif dans les expériences de laboratoire pour les analyses qualitatives et quantitatives.
- Chimie analytique : l’acétate de cuivre sert de réactif de test en chimie analytique pour détecter le sulfure d’hydrogène gazeux.
- Répulsif pour animaux : Il fonctionne comme un répulsif pour animaux pour dissuader certains parasites et animaux sauvages de zones spécifiques.
Les diverses applications de l’acétate cuivrique mettent en évidence son importance dans diverses industries, allant de la synthèse chimique à l’agriculture et au-delà. Une manipulation soigneuse et le respect des consignes de sécurité sont essentiels lors de l’utilisation de ce composé dans différents processus.
Des questions:
Q : L’acétate de cuivre II est-il covalent ?
R : Non, l’acétate cuivrique II est un composé ionique.
Q : Quel est le coefficient d’extinction molaire à 625 nm pour cette solution d’acétate de cuivre II ?
R : Le coefficient d’extinction molaire à 625 nm pour la solution d’acétate cuivrique II est spécifique à la concentration de la solution et doit être déterminé expérimentalement.
Q : Pouvez-vous mettre de l’acétate cuivrique monohydraté dans une fosse septique ?
R : Il n’est pas recommandé d’utiliser l’acétate de cuivre monohydraté comme nettoyant pour fosses septiques ou drains en raison de dangers potentiels et de préoccupations environnementales.
Q : Une réaction se produit-elle lorsque des solutions aqueuses d’acétate de baryum et de bromure de cuivre(II) sont combinées ?
R : Oui, une réaction se produit lorsque des solutions aqueuses d’acétate de baryum et de bromure cuivrique (II) sont combinées, entraînant la formation d’un précipité (bromure de baryum) et d’acétate cuivrique soluble.
Q : Quel est le point de fusion de l’acétate cuivrique ?
R : Le point de fusion de l’acétate cuivrique est d’environ 115°C à 120°C (239°F à 248°F).
Q : Comment fabriquer de l’acétate cuivrique à partir de sulfate de cuivre ?
R : Pour fabriquer de l’acétate cuivrique à partir de CuSO4, dissolvez CuSO4 dans l’eau, puis ajoutez de l’acide acétique à la solution jusqu’à ce que l’acétate cuivrique précipite. Filtrer et sécher le produit.
Q : Qu’est-ce que l’acétate cuivrique ?
R : L’acétate cuivrique est un composé chimique de formule Cu(CH3COO)2. C’est un solide cristallin bleu-vert et a diverses applications industrielles.
Q : L’acétate cuivrique est-il soluble dans l’eau ?
R : Oui, l’acétate cuivrique est modérément soluble dans l’eau, formant une solution bleu-vert.
Q : Pourquoi la solution d’acétate cuivrique est-elle trouble ?
R : La solution d’acétate cuivrique peut devenir trouble en raison de la présence d’impuretés ou de la formation de composés de cuivre insolubles, surtout si la solution n’est pas correctement préparée ou stockée.
Q : Oxydation du Cu(OAc)2 ?
R : L’acétate de cuivre (II) (Cu(OAc)2) peut agir comme agent oxydant dans certaines réactions, où il subit une réduction tout en oxydant d’autres substances.
