L’acétate de calcium (Ca(C2H3O2)2) est un composé composé de calcium et d’acide acétique. Il est couramment utilisé comme médicament pour réduire les niveaux de phosphate chez les personnes atteintes d’une maladie rénale.
| Nom UICPA | Acétate de calcium |
| Formule moléculaire | Ca(C2H3O2)2 |
| Numero CAS | 62-54-4 |
| Synonymes | Acide acétique, sel de calcium ; Acétate de calcium (français); Diacétate de calcium ; Éthanoate de calcium ; E263 |
| InChI | InChI=1S/2C2H4O2.Ca/c2 1-2(3)4;/h2 1H3,(H,3,4);/q;;+2/p-2 |
Propriétés de l’acétate de calcium
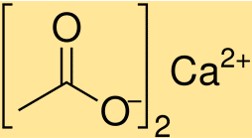
Formule d’acétate de calcium
La formule de l’acétate de calcium est Ca(C2H3O2)2. Cette formule indique qu’une mole d’acétate de calcium contient une mole d’ions calcium (Ca2+) et deux moles d’ions acétate (C2H3O2-). La formule de l’acétate de calcium est essentielle pour déterminer la stœchiométrie des réactions chimiques impliquant ce composé.
Acétate De Calcium Masse molaire
La masse molaire de Ca(C2H3O2)2 est de 158,17 g/mol. Cette valeur représente la masse d’une mole de Ca(C2H3O2)2, qui est égale à son poids moléculaire. La masse molaire est un paramètre crucial pour déterminer la stœchiométrie des réactions chimiques impliquant Ca(C2H3O2)2. Cette valeur est calculée en additionnant les masses atomiques de tous les atomes présents dans une mole de Ca(C2H3O2)2.
Point d’ébullition de l’acétate de calcium
Le point d’ébullition du Ca(C2H3O2)2 est de 160°C (320°F). Cette valeur indique la température à laquelle Ca(C2H3O2)2 change son état de liquide à gaz. Le point d’ébullition du Ca(C2H3O2)2 est nettement supérieur à celui de l’eau, qui bout à 100°C (212°F). Ce point d’ébullition élevé est dû à la nature ionique du Ca(C2H3O2)2 et à ses fortes forces intermoléculaires.
Acétate de calcium Point de fusion
Le point de fusion du Ca(C2H3O2)2 est de 160-170°C (320-338°F). Cette valeur indique la température à laquelle Ca(C2H3O2)2 change son état de solide à liquide. Le point de fusion du Ca(C2H3O2)2 est légèrement supérieur à celui de l’eau, qui fond à 0°C (32°F). Le point de fusion élevé du Ca(C2H3O2)2 est dû à la nature ionique du composé et à ses fortes forces intermoléculaires.
Densité d’acétate de calcium g/mL
La densité de Ca(C2H3O2)2 est de 1,5 g/mL. Cette valeur indique la masse de Ca(C2H3O2)2 présente dans un millilitre de sa solution. La densité du Ca(C2H3O2)2 est supérieure à celle de l’eau, qui a une densité de 1 g/mL. La densité élevée de Ca(C2H3O2)2 est due à sa nature ionique et à la présence d’ions calcium dans le composé.
Acétate De Calcium Poids moléculaire
Le poids moléculaire de Ca(C2H3O2)2 est de 158,17 g/mol. Cette valeur représente la somme des poids atomiques de tous les atomes présents dans une molécule de Ca(C2H3O2)2. Le poids moléculaire est un paramètre critique pour déterminer les propriétés du Ca(C2H3O2)2 et son comportement dans les réactions chimiques.
Structure de l’acétate de calcium
La structure du Ca(C2H3O2)2 est un composé ionique dans lequel les ions Ca2+ sont entourés de deux ions C2H3O2-. Les ions C2H3O2- agissent comme des ligands bidentés et forment des liaisons de coordination avec les ions Ca2+. La structure du Ca(C2H3O2)2 est cristalline et a une forme cubique.
| Apparence | Poudre cristalline blanche |
| Gravité spécifique | 1,5 g/ml |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 158,17 g/mole |
| Densité | 1,5 g/ml |
| Point de fusion | 160-170°C (320-338°F) |
| Point d’ébullition | 160°C (320°F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Soluble |
| Solubilité | Soluble dans l’eau, l’éthanol et l’acétone |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | 9.24 |
| pH | 7-8 (solution à 5 %) |
Sécurité et dangers de l’acétate de calcium
Le Ca(C2H3O2)2 est généralement considéré comme sûr lorsqu’il est utilisé selon les instructions. Cependant, l’exposition à de grandes quantités de Ca(C2H3O2)2 peut irriter la peau, les yeux et le système respiratoire. L’ingestion de grandes quantités de Ca(C2H3O2)2 peut entraîner des maux d’estomac, des vomissements et de la diarrhée. Il est important de manipuler le Ca(C2H3O2)2 avec précaution et d’éviter d’inhaler ou d’ingérer la substance. Le Ca(C2H3O2)2 peut également présenter un risque pour l’environnement, en particulier pour la vie aquatique, et doit être éliminé correctement. Comme pour tous les produits chimiques, il est important de lire et de suivre les instructions de sécurité figurant sur l’étiquette et d’utiliser un équipement de protection approprié lors de la manipulation du Ca(C2H3O2)2.
| Symboles de danger | Aucun |
| Description de la sécurité | Évitez l’inhalation, l’ingestion et le contact avec la peau et les yeux. Utiliser dans un endroit bien ventilé et porter un équipement de protection approprié. |
| Numéros d’identification de l’ONU | N’est pas applicable |
| Code SH | 291529 |
| Classe de danger | Non classé comme dangereux selon la norme OSHA Hazard Communication (29 CFR 1910.1200). |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | Faible toxicité. Peut provoquer une irritation de la peau et des yeux. L’ingestion de grandes quantités peut provoquer des troubles gastro-intestinaux. |
Méthodes de synthèse de l’acétate de calcium
Diverses méthodes permettent de synthétiser du Ca(C2H3O2)2.
Une méthode courante implique la réaction du carbonate de calcium avec l’acide acétique. Ajouter le carbonate de calcium à une solution d’acide acétique et chauffer le mélange à reflux. Filtrer le mélange et laisser le filtrat refroidir et cristalliser pour former Ca(C2H3O2)2.
Une autre méthode implique la réaction de l’hydroxyde de calcium avec l’acide acétique . Ajouter de l’hydroxyde de calcium à une solution d’acide acétique. Remuer et chauffer le mélange pour obtenir une solution claire. Filtrez la solution et laissez le filtrat refroidir et cristalliser pour former Ca(C2H3O2)2.
Une autre méthode implique la réaction de l’oxyde de calcium avec l’acide acétique . Ajoutez de l’oxyde de calcium à une solution d’acide acétique. Remuer et chauffer le mélange pour obtenir une solution claire. Filtrez la solution et laissez le filtrat refroidir et cristalliser pour former Ca(C2H3O2)2.
Le choix de la méthode de synthèse peut dépendre de facteurs tels que le rendement souhaité et la pureté du produit, ainsi que de l’application spécifique pour laquelle le Ca(C2H3O2)2 sera utilisé.
Utilisations de l’acétate de calcium
Ca(C2H3O2)2 a plusieurs applications dans divers domaines. Voici quelques utilisations courantes du Ca(C2H3O2)2 :
- Additif alimentaire : Utilisé comme additif alimentaire, en particulier dans les produits de boulangerie, pour améliorer la texture et prolonger la durée de conservation.
- Applications médicinales : Utilisé comme médicament pour le traitement des taux élevés de phosphate dans le sang chez les patients atteints d’insuffisance rénale chronique. Il agit en se liant au phosphate présent dans les aliments et en empêchant son absorption par l’organisme.
- Traitement de l’eau : Utilisé dans le traitement de l’eau pour réduire les niveaux de plomb et d’autres métaux lourds.
- Réactif de laboratoire : utilisé comme réactif dans les laboratoires pour diverses réactions chimiques.
- Agent antifongique : Également utilisé comme agent antifongique dans le traitement de certaines infections cutanées.
- Accélérateur de béton : Utilisé comme accélérateur de béton, ce qui contribue à accélérer le processus de prise du béton.
- Ignifuge : Utilisé comme ignifuge dans divers matériaux, notamment les plastiques et les textiles.
Des questions:
Q : L’acétate de calcium est-il acide, basique ou neutre ?
R : Ca(C2H3O2)2 est un composé basique.
Q : L’acétate de calcium est-il soluble dans l’eau ?
R : Oui, Ca(C2H3O2)2 est soluble dans l’eau.
Q : Comment fabriquer de l’acétate de calcium ?
R : Le Ca(C2H3O2)2 peut être fabriqué par diverses méthodes, notamment la réaction du carbonate de calcium ou de l’hydroxyde de calcium avec de l’acide acétique. Le mélange résultant est ensuite filtré et le filtrat peut refroidir et cristalliser, formant du Ca(C2H3O2)2.
Q : Où acheter de l’acétate de calcium ?
R : Le Ca(C2H3O2)2 peut être acheté auprès de fournisseurs de produits chimiques, de magasins de fournitures de laboratoire et de détaillants en ligne.
Q : L’acétate de calcium est-il ionique ou covalent ?
R : Ca(C2H3O2)2 est un composé ionique composé de cations calcium et d’anions acétate maintenus ensemble par des liaisons ioniques.
