L’acétamide est un solide cristallin blanc avec une légère odeur. Il est synthétisé en faisant réagir de l’acide acétique avec de l’ammoniac. Il est couramment utilisé dans la fabrication de plastiques et de produits pharmaceutiques.
| Nom UICPA | Éthanamide |
| Formule moléculaire | C2H5NO |
| Numero CAS | 60-35-5 |
| Synonymes | Amide d’acide acétique, éthamide, éthanamide, CH3CONH2 |
| InChI | InChI=1S/C2H5NO/c1-2(3)4/h1H3,(H2,3,4) |
Propriétés de l’acétamide
Acétamide Masse molaire
L’acétamide a une masse molaire de 59,07 g/mol, qui est la somme des masses atomiques de tous les atomes d’une molécule d’acétamide. La masse molaire d’un composé est utile pour déterminer le nombre de moles du composé présent dans un échantillon donné. Il est également utilisé pour calculer la composition en pourcentage en masse du composé.
Point d’ébullition de l’acétamide
Le point d’ébullition de l’éthanamide est de 222 °C. C’est la température à laquelle l’éthanamide passe d’un liquide à un gaz. Le point d’ébullition d’une substance est affecté par la force de ses forces intermoléculaires, et l’éthanamide possède de fortes liaisons hydrogène entre ses molécules. Par conséquent, il a un point d’ébullition relativement élevé par rapport aux autres amides.
Acétamide Point de fusion
Le point de fusion de l’éthanamide est de 82,5 °C. C’est la température à laquelle l’éthanamide passe d’un solide à un liquide. Le point de fusion d’une substance est influencé par la force de ses forces intermoléculaires et, dans le cas de l’éthanamide, il existe de fortes liaisons hydrogène entre ses molécules. Par conséquent, son point de fusion est relativement élevé par rapport aux autres amides.
Acétamide Densité g/ml
La densité de l’éthanamide est de 1,16 g/mL. La densité est la masse d’une substance par unité de volume et constitue une propriété physique utile pour identifier et caractériser les substances. L’acétamide est un composé relativement dense et sa densité peut être utilisée dans les calculs pour diverses applications.
Acétamide Poids moléculaire
Le poids moléculaire de l’acétamide est de 59,07 g/mol. Cette valeur est utile pour déterminer la quantité d’acétamide présente dans un échantillon, ainsi que pour les calculs stoechiométriques dans les réactions chimiques.
Structure de l’acétamide
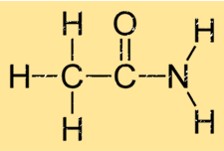
L’acétamide a une structure simple constituée d’un groupe carbonyle (C=O) attaché à un groupe amino (NH2). Cela lui donne la formule moléculaire C2H5NO. Les groupes carbonyle et amino sont reliés par un seul atome de carbone. La structure de l’éthanamide lui permet de former de fortes liaisons hydrogène avec d’autres molécules d’éthanamide, ce qui contribue à ses propriétés physiques telles que le point d’ébullition et le point de fusion.
Formule d’acétamide
La formule chimique de l’éthanamide est CH3CONH2, ce qui indique qu’il contient un atome de carbone, deux atomes d’hydrogène, un atome d’azote et un atome d’oxygène. La formule est utile pour identifier les éléments et leurs ratios présents dans le composé. Il est également utile pour déterminer la stœchiométrie des réactions chimiques impliquant l’éthanamide.
| Apparence | Solide cristallin blanc |
| Gravité spécifique | 1,16 g/ml |
| Couleur | Incolore |
| Odeur | Légère odeur |
| Masse molaire | 59,07 g/mole |
| Densité | 1,16 g/ml |
| Point de fusion | 82,5 °C |
| Point d’ébullition | 222 °C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Complètement miscible |
| Solubilité | Soluble dans l’éthanol, l’éther, le benzène et le chloroforme |
| La pression de vapeur | 0,000138 mmHg à 25°C |
| Densité de vapeur | 2.1 |
| pKa | 16,5 |
| pH | 6,5 – 7,5 (solution aqueuse à 10 %) |
Sécurité et dangers de l’acétamide
L’acétamide est considéré comme un composé relativement sûr, mais il peut néanmoins présenter certains dangers. Il peut provoquer une irritation de la peau, des yeux et du système respiratoire en cas d’exposition prolongée. Il peut également provoquer une irritation gastro-intestinale et une dépression du système nerveux central en cas d’ingestion. L’acétamide est combustible et peut provoquer des incendies s’il est exposé à la chaleur ou aux flammes. Il est important de manipuler l’éthanamide avec précaution et d’utiliser des équipements de protection, tels que des gants et des lunettes de sécurité, lorsque vous travaillez avec. Une ventilation et un stockage adéquats sont également nécessaires pour éviter une exposition inutile et minimiser les risques potentiels.
| Symboles de danger | Aucun |
| Description de la sécurité | Évitez une exposition prolongée. Portez un équipement de protection. Une ventilation et un stockage adéquats sont nécessaires. |
| Numéros d’identification de l’ONU | N’est pas applicable |
| Code SH | 29242990 |
| Classe de danger | Non classé comme dangereux par OSHA ou GHS |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | DL50 (orale, rat) : 3,8 g/kg ; CL50 (inhalation, rat) : >20 mg/L (exposition de 4 heures) |
Méthodes de synthèse de l’acétamide
L’ammoniac ou les sels d’ammonium peuvent réagir avec l’acide acétique pour synthétiser l’éthanamide, l’ammoniac peut réagir avec le chlorure d’acétyle pour synthétiser l’éthanamide et l’acétate d’ammonium peut subir une déshydratation pour synthétiser l’éthanamide.
Dans la première méthode, l’oxyde de zinc ou le cuivre catalyse la réaction de l’acide acétique et de l’ammoniac ou des sels d’ammonium pour synthétiser l’éthanamide. La réaction produit de l’éthanamide et de l’eau comme sous-produits.
Dans la deuxième méthode, une base telle que l’hydroxyde de sodium ou l’ammoniac gazeux réagit avec le chlorure d’acétyle pour produire de l’éthanamide. La réaction produit de l’éthanamide et du chlorure d’hydrogène gazeux comme sous-produits.
Dans la troisième méthode, un agent déshydratant tel que l’acide sulfurique facilite la déshydratation de l’acétate d’ammonium pour synthétiser de l’éthanamide et de l’eau comme sous-produit.
Utilisations de l’acétamide
L’acétamide a de nombreuses utilisations dans différentes industries en raison de ses propriétés uniques. Certaines des utilisations courantes de l’éthanamide sont :
- Solvant : Les fabricants l’utilisent souvent comme solvant pour produire des plastiques, des fibres et des résines.
- Industrie pharmaceutique : Utilisé dans l’industrie pharmaceutique comme matière première pour la synthèse de divers médicaments et également comme stabilisant pour certains antibiotiques.
- Industrie textile : Utilisé dans l’industrie textile comme adoucissant pour les fibres synthétiques telles que le nylon et comme agent de teinture pour le coton et d’autres fibres naturelles.
- Industrie chimique : également utilisé comme intermédiaire chimique dans la production de divers produits chimiques tels que l’acrylonitrile, l’anhydride acétique et l’acrylamide.
- Industrie alimentaire : utilisé comme agent aromatisant et comme ingrédient dans certains produits alimentaires tels que les produits de boulangerie, les bonbons et les glaces.
- Recherche en laboratoire : Utilisé dans la recherche en laboratoire comme solvant, réactif et également comme dénaturant pour les protéines.
Des questions:
Q : Quel réactif ou séquence de réactifs convertira l’acétamide en acétate d’éthyle ?
R : L’acétamide peut être converti en acétate d’éthyle en le faisant réagir avec du chloroformiate d’éthyle en présence d’une base telle que la pyridine. La réaction produit de l’acétate d’éthyle, du dioxyde de carbone et du chlorure d’hydrogène gazeux comme sous-produits.
Q : L’acétamide est-il un acide aminé ?
R : Non, l’éthanamide n’est pas un acide aminé. C’est un dérivé de l’acide acétique et contient un groupe fonctionnel amide (-CONH2) au lieu d’un groupe amino (-NH2).
Q : Quel est le produit de la réaction de l’acétamide avec HO- ?
R : La réaction de l’acétamide avec HO- (ion hydroxyde) entraîne l’hydrolyse de l’acétamide pour former de l’acide acétique et de l’ammoniac.
Q : Comment éliminer le solvant acétamide des cristaux ?
R : Pour éliminer le solvant éthanamide des cristaux, on peut utiliser des techniques telles que la recristallisation ou la filtration sous vide. La recristallisation consiste à dissoudre les cristaux dans un solvant approprié, tel que l’eau, puis à laisser le solvant s’évaporer lentement pour obtenir des cristaux purs. La filtration sous vide consiste à filtrer les cristaux à travers un papier filtre sous pression réduite pour éliminer tout solvant éthanamide résiduel.
Q : L’acétamide a-t-il une liaison hydrogène ?
R : Oui, l’éthanamide peut participer à la liaison hydrogène en raison de la présence d’un accepteur de liaison hydrogène (-CO) et d’un donneur de liaison hydrogène (-NH2) dans sa structure moléculaire.
