Le bicarbonate de sodium (NaHCO3), également connu sous le nom de bicarbonate de soude, est une poudre cristalline blanche au léger goût alcalin. Il est couramment utilisé comme agent levant dans la pâtisserie, comme agent de nettoyage et dans le traitement de l’indigestion acide et des brûlures d’estomac.
| Nom UICPA | Carbonate acide de sodium |
| Formule moléculaire | NaHCO3 |
| Numero CAS | 144-55-8 |
| Synonymes | Bicarbonate de soude, carbonate acide de sodium, hydrogénocarbonate de sodium |
| InChI | InChI=1S/CHNaO3/c2-1(3)4/h(H,2,3)(H2,1,2,3)/p-1 |
Propriétés du bicarbonate de sodium
Bicarbonate De Sodium masse molaire
La masse molaire de NaHCO3 est de 84,007 g/mol. C’est la somme des masses atomiques de ses éléments constitutifs : le sodium, l’hydrogène, le carbone et l’oxygène.
Point d’ébullition du bicarbonate de sodium
Le carbonate acide de sodium n’a pas de point d’ébullition défini car il se décompose avant d’être bouilli. La température de décomposition du bicarbonate de sodium est de 851°C, moment auquel il se décompose en carbonate de sodium, dioxyde de carbone et eau.
Point de fusion du bicarbonate de sodium
Le carbonate acide de sodium a un point de fusion de 50 °C, point auquel il passe d’un solide à une poudre cristalline blanche.
Densité du bicarbonate de sodium g/ml
La densité du carbonate acide de sodium est d’environ 2,165 g/mL. Cette valeur peut varier légèrement en fonction de la granulométrie et du degré de compactage du matériau.
Poids moléculaire du bicarbonate de sodium
Le poids moléculaire du bicarbonate de sodium est de 84,007 g/mol, calculé à partir de sa formule moléculaire NaHCO3.
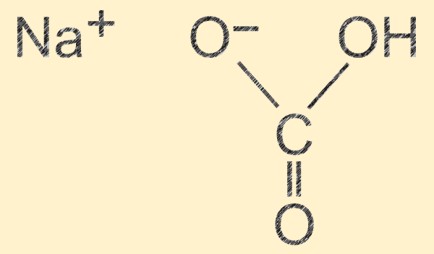
Structure du bicarbonate de sodium
L’hydrogénocarbonate de sodium a une structure moléculaire composée d’un ion sodium (Na+), d’un ion hydrogène (H+), d’un ion carbonate (CO32-) et de trois ions oxygène (O2-). Les ions sont disposés dans une unité répétitive qui forme une structure cristalline, avec une liaison hydrogène entre les molécules. La nature ionique du composé lui confère ses propriétés fondamentales et la liaison hydrogène contribue à sa stabilité physique.
| Apparence | Poudre cristalline blanche |
| Gravité spécifique | 2,165 g/ml |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 84,007 g/mole |
| Densité | 2,165 g/ml |
| Point de fusion | 50°C |
| Point d’ébullition | Se décompose à 851°C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Soluble dans l’eau |
| Solubilité | Soluble dans l’eau |
| La pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | 8.1 |
| pH | 8,1 (10 g/L, 25 °C) |
Sécurité et dangers du bicarbonate de sodium
Le bicarbonate de sodium est un composé sûr et couramment utilisé avec un faible niveau de toxicité. Il est généralement considéré comme non dangereux, ininflammable et non explosif. L’ingestion de grandes quantités peut provoquer des troubles digestifs et augmenter le risque de développer des calculs rénaux. Le contact avec la peau peut provoquer une légère irritation et l’inhalation de poussière peut provoquer une irritation des voies respiratoires. Il est important de manipuler le NaHCO3 avec précaution pour éviter l’inhalation de poussières et tout contact avec la peau.
| Symboles de danger | N’est pas applicable |
| Description de la sécurité | S24/25 |
| Numéros d’identification de l’ONU | UN3077, MATIÈRE DANGEREUSE POUR L’ENVIRONNEMENT, SOLIDE, NSA (Bicarbonate de sodium) |
| Code SH | 2836.90.90 |
| Classe de danger | 9 |
| Groupe d’emballage | III |
| Toxicité | Faible toxicité en cas d’ingestion, d’inhalation ou de contact avec la peau |
Méthodes de synthèse du bicarbonate de sodium
Le bicarbonate de sodium (NaHCO3) peut être synthétisé par plusieurs méthodes, dont le procédé Solvay, qui est la méthode la plus couramment utilisée pour la production à grande échelle. Le procédé Solvay implique la réaction du chlorure de sodium, de l’ammoniac et du dioxyde de carbone pour produire de l’hydrogénocarbonate de sodium et du chlorure de calcium. Le carbonate acide de sodium peut également être synthétisé par la réaction de NaHCO3 et de dioxyde de carbone, ou par la réaction de l’hydroxyde de sodium et du dioxyde de carbone. Ces méthodes produisent une forme de NaHCO3 de haute pureté, qui peut être davantage purifiée par recristallisation.
Utilisations du bicarbonate de sodium
Le carbonate acide de sodium, communément appelé bicarbonate de soude, a un large éventail d’utilisations en raison de ses propriétés uniques. En cuisine, il est souvent utilisé comme agent levant pour les produits de boulangerie, tels que les gâteaux et le pain. Dans les soins personnels, il est utilisé comme abrasif doux dans le dentifrice et comme déodorant. Il est également utilisé dans l’industrie alimentaire comme ajusteur de pH et agent neutralisant. Le carbonate acide de sodium a également des utilisations médicinales, comme le traitement des brûlures d’estomac, de l’indigestion et de l’acidité. De plus, il est utilisé dans la fabrication de produits de nettoyage et d’extincteurs en raison de ses propriétés extinctrices. Le carbonate acide de sodium a également des utilisations environnementales, car il peut être utilisé pour neutraliser les eaux usées acides.
