L’oxyde de plomb (PbO) est un composé formé de plomb et d’oxygène. Il est utilisé dans la production de batteries, de céramiques et de verre en raison de ses propriétés et applications distinctes.
| Nom UICPA | Oxyde de plomb (II) |
| Formule moléculaire | PbO |
| Numero CAS | 1317-36-8 |
| Synonymes | Monoxyde de plomb, oxyde de plomb (II), litharge |
| InChI | InChI=1S/2O.Pb |
Propriétés de l’oxyde de plomb
Formule d’oxyde de plomb
La formule chimique du monoxyde de plomb est PbO. Il se compose d’un atome de plomb (Pb) et d’un atome d’oxygène (O), ce qui donne une structure moléculaire simple et bien définie.
Oxyde De Plomb Masse molaire
La masse molaire du monoxyde de plomb (PbO) est d’environ 223,2 grammes par mole (g/mol). Cette valeur est obtenue en additionnant les masses atomiques d’un atome de plomb et d’un atome d’oxygène.
Point d’ébullition de l’oxyde de plomb
Le monoxyde de plomb n’a pas de point d’ébullition distinct car il subit une décomposition avant d’atteindre son point d’ébullition. Lorsqu’il est chauffé, il se transforme en plomb métallique et en oxygène gazeux.
Point de fusion de l’oxyde de plomb
Le point de fusion du monoxyde de plomb (PbO) est d’environ 888°C (1 630°F). À cette température, le monoxyde de plomb solide se transforme en liquide fondu, facilitant ainsi diverses applications industrielles.
Densité d’oxyde de plomb g/mL
Le monoxyde de plomb a une densité d’environ 9,53 grammes par millilitre (g/mL). Cette haute densité le rend utile dans diverses industries comme la production de céramique et de verre.
Poids moléculaire de l’oxyde de plomb
Le poids moléculaire du monoxyde de plomb (PbO) est de 223,2 g/mol. Cette valeur représente la somme des masses atomiques de plomb et d’oxygène dans une seule molécule de monoxyde de plomb.
Structure de l’oxyde de plomb
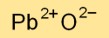
Le monoxyde de plomb possède une structure de réseau cristallin, avec des cations de plomb (Pb2+) occupant des positions sur le réseau et des anions d’oxyde (O2-) remplissant les espaces interstitiels. Cet arrangement aboutit à une liaison ionique stable.
Solubilité de l’oxyde de plomb
Le monoxyde de plomb (PbO) présente une faible solubilité dans l’eau. Il ne se dissout que légèrement dans l’eau, formant une solution basique grâce à l’hydrolyse des cations plomb. Sa solubilité peut augmenter dans les environnements acides.
| Apparence | Poudre jaune ou rouge |
| Gravité spécifique | 9,53 g/ml |
| Couleur | Jaune ou rouge |
| Odeur | Inodore |
| Masse molaire | 223,2 g/mole |
| Densité | 9,53 g/cm³ |
| Point de fusion | 888 °C (1 630 °F) |
| Point d’ébullition | Se décompose avant de bouillir |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Légèrement soluble |
| Solubilité | Faible solubilité, peut augmenter dans les environnements acides |
| Pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | N’est pas applicable |
| pH | Basique (en solution aqueuse) |
Sécurité et dangers liés à l’oxyde de plomb
Le monoxyde de plomb présente des risques potentiels pour la sécurité et nécessite une manipulation prudente. L’inhalation ou l’ingestion de poussières ou de vapeurs de monoxyde de plomb peut entraîner un empoisonnement au plomb, affectant négativement le système nerveux et les organes. Une ventilation adéquate et un équipement de protection individuelle sont essentiels lors de la manipulation de ce composé. Évitez tout contact avec les yeux, la peau ou les vêtements pour éviter les irritations. De plus, le monoxyde de plomb est nocif pour la vie aquatique et l’environnement ; son rejet dans les plans d’eau doit être strictement évité. Des méthodes appropriées de stockage et d’élimination doivent être suivies pour minimiser les risques. Respectez toujours les consignes de sécurité et les mesures réglementaires lorsque vous travaillez avec du monoxyde de plomb.
| Symboles de danger | Danger pour la santé |
| Description de la sécurité | – L’inhalation ou l’ingestion peut provoquer un empoisonnement au plomb et endommager les organes. – Évitez tout contact avec les yeux et la peau pour éviter les irritations. – Manipuler avec une ventilation adéquate et un équipement de protection individuelle. Eviter le rejet dans l’environnement. Suivez les consignes de sécurité. |
| Numéros d’identification de l’ONU | UN3077 |
| Code SH | 2824.90.7000 |
| Classe de danger | 9 (Matières et objets dangereux divers) |
| Groupe d’emballage | III |
| Toxicité | Toxique pour la vie aquatique avec des effets à long terme. |
Méthodes de synthèse de l’oxyde de plomb
La synthèse du monoxyde de plomb implique plusieurs méthodes. Une approche courante comprend la décomposition thermique du nitrate de plomb, où nous chauffons le nitrate de plomb (Pb(NO3)2) à une température spécifique. Ce processus décompose le nitrate de plomb en monoxyde de plomb (PbO), en dioxyde d’azote (NO2) et en oxygène gazeux (O2). La réaction chimique représente :
2 Pb(NO3)2 → 2 PbO + 4 NO2 + O2
Une autre méthode implique l’oxydation du plomb métallique. Le plomb métallique réagit avec l’oxygène pour produire du monoxyde de plomb :
2 Pb + O2 → 2 PbO
De plus, soumettre le plomb à la corrosion dans des conditions acides produit du monoxyde de plomb. Dans ce scénario, le plomb réagit avec l’oxygène et l’eau pour produire du monoxyde de plomb :
2 Pb + 2 H2O + O2 → 2 PbO + 2 H2O
Ces méthodes sont cruciales pour produire du monoxyde de plomb destiné à diverses applications, telles que la fabrication de batteries, de céramiques et de pigments. Cependant, il est essentiel de manipuler les composés du plomb avec prudence en raison de leurs risques potentiels pour la santé et l’environnement.
Utilisations de l’oxyde de plomb
Le monoxyde de plomb trouve diverses applications dans diverses industries en raison de ses propriétés uniques. Voici ses utilisations courantes :
- Céramiques : Il agit comme un flux dans la production de céramique, améliorant les caractéristiques de fusion et la qualité globale des matériaux céramiques.
- Protection contre les rayonnements : Sa haute densité et son efficacité à absorber les rayonnements font du monoxyde de plomb un matériau approprié pour la protection contre les rayonnements dans les installations médicales et les industries nucléaires.
- Stabilisateur de PVC : Il fonctionne comme stabilisant thermique et lubrifiant dans le traitement du polychlorure de vinyle (PVC), aidant à la fabrication de tuyaux, câbles et autres produits en PVC.
- Dispositifs semi-conducteurs : il sert de matériau dans certains dispositifs semi-conducteurs, tels que les varistances au monoxyde de plomb, utilisés pour la protection contre les surtensions.
- Batteries au plomb : les batteries au plomb utilisent le monoxyde de plomb comme composant essentiel, ce qui leur confère les propriétés nécessaires pour une utilisation dans les véhicules, les alimentations de secours et les sources d’alimentation sans interruption.
- Production de verre : le monoxyde de plomb joue un rôle essentiel dans la production de verre au plomb, lui conférant un indice de réfraction et une brillance accrus, le rendant ainsi parfaitement adapté à des fins décoratives et optiques.
- Application des pigments : Les peintures et revêtements bénéficient de divers pigments à base de plomb, tels que le minium (Pb3O4), en raison de leurs couleurs éclatantes et de leur résistance aux intempéries.
- Utilisation dans l’industrie du caoutchouc : L’industrie du caoutchouc utilise le monoxyde de plomb comme accélérateur et agent de vulcanisation, améliorant efficacement les propriétés et la durabilité des produits en caoutchouc.
Bien que le monoxyde de plomb ait d’importantes applications industrielles, il est essentiel de le manipuler avec précaution en raison de ses risques potentiels pour la santé et l’environnement. Des mesures et réglementations de sécurité appropriées sont essentielles pour garantir son utilisation responsable dans diverses industries.
Des questions:
Q : Laquelle des propositions suivantes est une équation équilibrée représentant la décomposition de l’oxyde de plomb (IV) ?
R : L’équation équilibrée pour la décomposition de l’oxyde de plomb (IV) est PbO2 → PbO + O2.
Q : Quelle est la formule chimique de l’oxyde de plomb (IV) ?
R : La formule chimique de l’oxyde de plomb (IV) est PbO2.
Q : Combien de grammes d’oxyde de plomb (II) seront produits à partir de 86,5 grammes d’iodure de potassium ?
R : Pour déterminer les grammes d’oxyde de plomb (II) produits, nous avons besoin d’une équation de réaction chimique impliquant l’iodure de potassium et le PbO.
Q : Qu’est-ce que le monoxyde de plomb ?
R : Le monoxyde de plomb fait référence à tout composé contenant du plomb et de l’oxygène, et il existe sous plusieurs formes, notamment l’oxyde de plomb (II) (PbO) et l’oxyde de plomb (IV) (PbO2).
Q : 0,632 moles de plomb ont été oxydées en nitrate de plomb (II). Combien de moles d’argent seraient déposées ?
R : Pour calculer les moles d’argent déposées, nous avons besoin d’une équation chimique équilibrée représentant la réduction du nitrate de plomb (II) en argent.
Q : Quel est le nom du PbO ?
R : Le nom du PbO est oxyde de plomb (II).
Q : Quel est l’indice d’oxydation du plomb ?
R : L’indice d’oxydation du plomb dans le PbO est de +2, et dans le PbO2, il est de +4.
Q : Le PbO est-il amphotère ?
R : Non, le PbO n’est pas amphotère ; il ne présente pas de propriétés acides ou basiques.
Q : Qu’est-ce que le PbO ?
R : PbO est la formule chimique de l’oxyde de plomb (II), un composé utilisé dans diverses applications, notamment les batteries au plomb et la fabrication du verre.
Q : Comment équilibrer l’équation Pb(NO3)2 = PbO + NO2 + O2 ?
R : L’équation équilibrée pour la décomposition du nitrate de plomb (II) (Pb(NO3)2) est 2Pb(NO3)2 = 2PbO + 4NO2 + O2.
