L’oxyde d’ammonium ((NH4)2O) est un composé cristallin blanc soluble dans l’eau et agit comme une base faible. Il est produit par la réaction de l’ammoniac et de l’oxygène et est utilisé dans les engrais, les agents de nettoyage et comme extincteur.
| Nom UICPA | Oxyde d’ammonium |
| Formule moléculaire | (NH4)2O |
| Numero CAS | 12046-03-6 |
| Synonymes | Hydroxyde d’ammonium, solution d’ammoniaque, Aqua Ammonia |
| InChI | InChI=1S/H4N.O/h1H4;/q+1;-1 |
Propriétés de l’oxyde d’ammonium
Formule d’oxyde d’ammonium
La formule de l’oxyde d’ammonium est (NH4)2O. C’est un composé composé d’un atome d’azote et de quatre atomes d’hydrogène combinés à un atome d’oxygène.
Oxyde D’Ammonium Masse molaire
La masse molaire de l’oxyde d’ammonium est d’environ 52,07 grammes par mole. Il est calculé en additionnant les poids atomiques de tous les atomes présents dans la molécule. La masse molaire aide à déterminer le nombre de particules présentes dans une quantité donnée d’une substance.
Point d’ébullition de l’oxyde d’ammonium
Le point d’ébullition du (NH4)2O est d’environ 90°C. C’est la température à laquelle la pression de vapeur d’un liquide est égale à la pression qui l’entoure, provoquant la transformation du liquide en gaz. Le point d’ébullition d’une substance est une propriété physique importante qui peut être utilisée pour identifier et distinguer différents composés.
Point de fusion de l’oxyde d’ammonium
Le point de fusion du (NH4)2O est d’environ -6°C. C’est la température à laquelle un solide se transforme en liquide. Le point de fusion d’une substance peut être utilisé pour identifier et distinguer différents composés, ainsi que pour déterminer la pureté d’une substance.
Densité d’oxyde d’ammonium g/ml
La densité de (NH4)2O est d’environ 1,02 g/ml. La densité est la quantité de masse par unité de volume et constitue une propriété physique fondamentale d’une substance. La densité d’une substance peut être utilisée pour identifier et distinguer différents composés, ainsi que pour déterminer la pureté d’une substance.
Poids moléculaire de l’oxyde d’ammonium
Le poids moléculaire de l’oxyde d’ammonium est d’environ 52,07 g/mol. C’est la somme des poids atomiques de tous les atomes présents dans une molécule de la substance. Le poids moléculaire peut être utilisé pour calculer les moles d’une substance présente dans une masse donnée et constitue une propriété physique importante utilisée dans de nombreux domaines scientifiques.
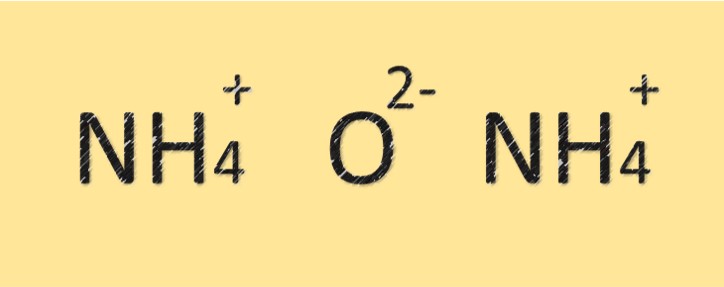
Structure de l’oxyde d’ammonium
L’oxyde d’ammonium est un composé composé d’atomes d’azote et d’oxygène. Il a une formule moléculaire de (NH4)2O et est composé de deux atomes d’azote et d’un atome d’oxygène. L’atome d’azote est lié à l’atome d’oxygène par une liaison covalente et possède également une charge positive. Le composé a un caractère basique ou alcalin en raison de la présence de l’ion ammonium.
| Apparence | Solide cristallin blanc |
| Gravité spécifique | 1,02 g/cm³ |
| Couleur | Blanc |
| Odeur | Ammoniaque |
| Masse molaire | 52,07 g/mole |
| Densité | 1,02 g/cm³ |
| Point de fusion | -6°C |
| Point d’ébullition | 90°C |
| Point d’éclair | N / A |
| Solubilité dans l’eau | Soluble |
| Solubilité | Soluble dans l’eau |
| La pression de vapeur | N / A |
| Densité de vapeur | N / A |
| pKa | N / A |
| pH | 11,6 (100 g/L, H2O, 20°C) |
Sécurité et dangers de l’oxyde d’ammonium
Le (NH4)2O est irritant pour les yeux, la peau et le système respiratoire. L’inhalation de ses vapeurs peut provoquer de la toux, un essoufflement et une irritation des poumons. Le contact avec la peau peut provoquer des démangeaisons et des rougeurs. Le composé doit être manipulé avec prudence et des mesures de protection telles que des gants et des lunettes de protection doivent être utilisées. En cas d’exposition, les zones touchées doivent être rincées à l’eau et des soins médicaux doivent être recherchés si les symptômes persistent. Il est également inflammable et doit être tenu à l’écart des sources d’inflammation.
| Symboles de danger | Irritant |
| Description de la sécurité | S26-S36/37/39 |
| Numéros d’identification de l’ONU | UN2672 |
| Code SH | 2841.90.90 |
| Classe de danger | 8 |
| Groupe d’emballage | III |
| Toxicité | Irritant pour les yeux, la peau et le système respiratoire |
Méthodes de synthèse de l’oxyde d’ammonium
Le (NH4)2O peut être synthétisé par plusieurs méthodes, notamment la décomposition thermique du nitrate d’ammonium et la réaction entre l’ammoniac gazeux et l’oxygène gazeux.
Une méthode implique la décomposition thermique du nitrate d’ammonium, qui est un engrais courant. La réaction produit de l’ammoniac et du dioxyde d’azote, qui sont ensuite oxydés en dioxyde d’azote et en monoxyde d’azote. Le monoxyde d’azote réagit avec davantage d’ammoniac gazeux pour former (NH4)2O.
Une autre méthode consiste à faire passer de l’ammoniac gazeux sur un catalyseur chauffé, ce qui provoque la combinaison des atomes d’azote et d’oxygène et la formation de (NH4)2O. Ces deux méthodes produisent du (NH4)2O sous forme de solide cristallin blanc, qui peut être purifié par recristallisation.
Utilisations de l’oxyde d’ammonium
Les industries utilisent le (NH4)2O à diverses fins en raison de sa teneur élevée en ammonium et de ses fortes propriétés alcalines. En tant qu’engrais, il constitue une source d’azote pour les plantes. Les agents de nettoyage l’utilisent pour dissoudre la graisse et la saleté. L’industrie métallurgique l’utilise comme agent réducteur pour les oxydes métalliques, notamment dans la production d’aluminium. En tant que réfrigérant, il est utilisé dans les systèmes de refroidissement industriels et comme source d’azote dans la production d’acide nitrique. En laboratoire, les chimistes l’utilisent comme source d’ammoniac pour les réactions chimiques. La polyvalence du (NH4)2O en fait un produit chimique précieux avec de multiples applications dans tous les secteurs.
