Le nitrate de lithium (LiNO₃) est un composé chimique utilisé dans diverses applications. Il présente des propriétés uniques, telles que sa solubilité dans l’eau et son rôle dans la production de céramique et de verre.
| Nom UICPA | Nitrate de lithium |
| Formule moléculaire | LiNO₃ |
| Numero CAS | 7790-69-4 |
| Synonymes | Nitrate de lithium, sel de lithium d’acide nitrique, nitrate de lithium (I) |
| InChi | InChI=1S/Li.NO3/c;2-1(3)4/q+1;-1 |
Propriétés du nitrate de lithium
Formule de nitrate de lithium
La formule du sel de lithium de l’acide nitrique est LiNO₃. Il se compose d’un atome de lithium (Li), d’un atome d’azote (N) et de trois atomes d’oxygène (O). Cette formule chimique représente la composition de chaque élément du composé.
Nitrate De Lithium Masse molaire
Le sel de lithium de l’acide nitrique a une masse molaire d’environ 68,95 g/mol. La masse molaire fait référence à la masse d’une mole d’une substance et est calculée en additionnant les masses atomiques de tous les atomes de la formule.
Point d’ébullition du nitrate de lithium
Le sel de lithium de l’acide nitrique a un point d’ébullition d’environ 600°C (1112°F). Le point d’ébullition est la température à laquelle une substance passe d’un liquide à un gaz sous pression atmosphérique standard.
Point de fusion du nitrate de lithium
Le sel de lithium de l’acide nitrique a un point de fusion d’environ 255°C (491°F). Le point de fusion est la température à laquelle une substance passe d’un solide à un liquide sous pression atmosphérique standard.
Densité du nitrate de lithium g/mL
La densité du sel de lithium de l’acide nitrique est d’environ 2,38 g/mL. La densité représente la masse d’une substance par unité de volume et constitue une propriété importante pour comprendre son comportement physique.
Lithium-Nitrate Poids moléculaire
Le poids moléculaire du sel de lithium de l’acide nitrique est de 68,95 g/mol. Le poids moléculaire est la somme des poids atomiques de tous les atomes d’une molécule et est exprimé en grammes par mole.
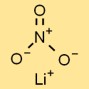
Structure du nitrate de lithium
Le sel de lithium de l’acide nitrique a une structure cristalline ionique, où les cations lithium (Li⁺) et les anions nitrate (NO₃⁻) forment un motif répétitif régulier. Cette structure contribue à sa stabilité et à ses propriétés caractéristiques.
Solubilité du nitrate de lithium
Le sel de lithium de l’acide nitrique est hautement soluble dans l’eau. Cette haute solubilité est l’une de ses caractéristiques essentielles et la rend utile dans diverses applications, comme dans la production de céramique et de verre.
| Apparence | Solide blanc |
| Gravité spécifique | N / A |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 68,95 g/mole |
| Densité | 2,38 g/ml |
| Point de fusion | 255°C (491°F) |
| Point d’ébullition | 600°C (1112°F) |
| Point d’éclair | N / A |
| Solubilité dans l’eau | Très soluble |
| Solubilité | Soluble dans l’eau et les solvants organiques tels que l’éthanol |
| La pression de vapeur | N / A |
| Densité de vapeur | N / A |
| pKa | N / A |
| pH | N / A |
Veuillez noter que certaines propriétés peuvent ne pas être applicables (N/A) ou avoir des données limitées disponibles pour le nitrate de lithium.
Sécurité et dangers du nitrate de lithium
Le sel de lithium de l’acide nitrique pose certaines considérations de sécurité et de danger. Il peut être irritant pour la peau, les yeux et les voies respiratoires par contact ou par inhalation. Lors de la manipulation, il est essentiel d’utiliser des équipements de protection appropriés comme des gants et des lunettes de sécurité. Évitez l’ingestion, car cela pourrait provoquer une gêne gastro-intestinale. Conservez-le à l’écart des substances incompatibles pour éviter des réactions dangereuses. En cas de déversements ou de fuites, confinez-les et nettoyez-les rapidement. De plus, suivez toujours les directives de stockage appropriées et conservez-le dans un endroit sécurisé et bien ventilé. Donnez la priorité aux pratiques de manipulation sûres et respectez les protocoles de sécurité pertinents pour minimiser les risques associés au sel de lithium de l’acide nitrique.
| Symboles de danger | Avertissement |
| Description de la sécurité | – Irritant pour la peau, les yeux et les voies respiratoires. – Eviter l’ingestion. – Utiliser un équipement de protection. – Conserver dans un endroit bien ventilé. |
| Numéros d’identification de l’ONU | UN1477 |
| Code SH | 28342990 |
| Classe de danger | 5.1 (Agent comburant) |
| Groupe d’emballage | II |
| Toxicité | Faible toxicité, mais doit être manipulé avec soin et avec des mesures de sécurité appropriées. |
Veuillez noter que les symboles de danger et les recommandations de sécurité spécifiques peuvent varier en fonction de la juridiction et des réglementations. Reportez-vous toujours aux fiches de données de sécurité appropriées et aux directives de sécurité locales pour la manipulation du sel de lithium d’acide nitrique.
Méthodes de synthèse du nitrate de lithium
Il existe plusieurs méthodes pour synthétiser le sel de lithium de l’acide nitrique.
Une approche courante implique la réaction entre le carbonate de lithium (Li₂CO₃) et l’acide nitrique (HNO₃) . Au cours de ce processus, les deux composés réagissent pour produire du sel de lithium d’acide nitrique et de l’eau (H₂O) comme sous-produits. L’équation chimique de cette réaction est :
Li₂CO₃ + 2HNO₃ → 2LiNO₃ + H₂O
Une autre méthode consiste à faire réagir de l’hydroxyde de lithium (LiOH) avec de l’acide nitrique pour obtenir du sel de lithium d’acide nitrique et de l’eau. L’équation de la réaction est :
LiOH + HNO₃ → LiNO₃ + H₂O
Le sel de lithium de l’acide nitrique se forme en neutralisant l’acide nitrique avec de l’oxyde de lithium (Li₂O) ou du carbonate de lithium. Les équations sont :
Li₂O + 2HNO₃ → 2LiNO₃ + H₂O Li₂CO₃ + 2HNO₃ → 2LiNO₃ + CO₂ + H₂O
Dans toutes ces méthodes, il est important de manipuler les réactifs et les produits avec prudence en raison de leur réactivité et des dangers potentiels. Des mesures de sécurité appropriées et des conditions contrôlées sont essentielles pendant le processus de synthèse pour garantir le succès de la production de sel de lithium d’acide nitrique.
Utilisations du nitrate de lithium
Le sel de lithium de l’acide nitrique trouve diverses applications en raison de ses propriétés uniques. Voici ses utilisations :
- Traitement de l’air : le sel de lithium d’acide nitrique agit comme un dessicant dans les applications de traitement de l’air, éliminant l’humidité de l’air pour prévenir la corrosion et maintenir des conditions environnementales optimales.
- Réactifs dans la synthèse chimique : Il sert de source d’ions nitrate dans diverses réactions chimiques, ce qui le rend utile dans la synthèse d’autres composés et substances.
- Produits chimiques spécialisés : ils trouvent des applications dans la production de produits chimiques spécialisés, notamment des catalyseurs et des inhibiteurs de corrosion.
- Pièces pyrotechniques et feux d’artifice : Le sel de lithium de l’acide nitrique joue un rôle crucial en tant qu’oxydant dans les pièces pyrotechniques, contribuant à la couleur rouge vif observée dans les feux d’artifice.
- Industrie pharmaceutique : L’industrie pharmaceutique utilise le sel de lithium de l’acide nitrique comme réactif dans la synthèse chimique et la recherche pour certaines formulations pharmaceutiques.
- Batteries au lithium : Bien qu’il ne soit pas directement utilisé dans les batteries, le sel de lithium d’acide nitrique est pertinent pour l’industrie des batteries lithium-ion. Les fabricants incorporent des sels de lithium dérivés du sel de lithium de l’acide nitrique dans les électrolytes utilisés dans ces batteries.
- Réacteurs nucléaires : Certains types de réacteurs nucléaires utilisent du sel de lithium d’acide nitrique comme liquide de refroidissement en raison de ses propriétés d’absorption des neutrons.
- Production de céramique et de verre : Dans les procédés de fabrication de céramique et de verre, le sel de lithium d’acide nitrique agit comme agent fondant. Il abaisse efficacement le point de fusion des matériaux, améliorant ainsi leur maniabilité et la qualité du produit.
- Fluides caloporteurs : Le sel de lithium de l’acide nitrique trouve une application dans les fluides caloporteurs, en particulier dans les systèmes d’énergie solaire, en raison de sa haute solubilité dans l’eau. Il facilite un échange thermique efficace et permet le stockage de l’énergie thermique.
Des questions:
Q : Combien d’atomes au total y a-t-il dans une molécule de nitrate de lithium, LiNO₃ ?
R : Il y a 5 atomes dans une molécule de sel de lithium d’acide nitrique : 1 atome de lithium (Li), 1 atome d’azote (N) et 3 atomes d’oxygène (O).
Q : Quelles sont les formules correctes pour le nitrate de cuivre (II) hexahydraté et le chromate de lithium dihydraté ?
R : Les formules correctes sont Cu(NO₃)₂·6H₂O pour le nitrate de cuivre (II) hexahydraté et Li₂CrO₄·2H₂O pour le chromate de lithium dihydraté.
Q : Combien de grammes de nitrate de lithium seront nécessaires pour préparer 250 ml d’une solution 0,5 M ?
R : Vous aurez besoin de 17,24 grammes de sel de lithium d’acide nitrique pour préparer 250 ml d’une solution 0,5 M.
Q : Le nitrate de lithium est-il ionique ou covalent ?
R : Le sel de lithium de l’acide nitrique est un composé ionique.
Q : Le LiNO₃ est-il soluble dans l’eau ?
R : Oui, le nitrate de lithium (LiNO₃) est soluble dans l’eau.
Q : Quel coefficient doit apparaître devant LiNO₃ dans l’équation équilibrée ?
R : Le coefficient « 2 » doit apparaître devant LiNO₃ dans l’équation équilibrée.
Q : Combien des composés suivants sont solubles dans l’eau ? Pb(OH)₂, LiNO₃, NH₄Br, K₂S
R : Trois des composés sont solubles dans l’eau : LiNO₃, NH₄Br et K₂S.
Q : LiNO₃ est-il soluble ?
R : Oui, LiNO₃ est soluble.
Q : Le LiNO₃ est-il aqueux ou solide ?
R : LiNO₃ est aqueux lorsqu’il est dissous dans l’eau.
Q : LiNO₃ est-il acide, basique ou neutre ?
R : Le sel de lithium de l’acide nitrique (LiNO₃) est un composé neutre.
Q : Combien d’atomes au total y a-t-il dans une molécule de nitrate de lithium, LiNO₃ ?
R : Il y a 5 atomes dans une molécule de nitrate de lithium : 1 atome de lithium (Li), 1 atome d’azote (N) et 3 atomes d’oxygène (O).
Q : Le LiNO₃ est-il ionique ou covalent ?
R : LiNO₃ est un composé ionique.
