Le 4-éthylphénol ou C8H10O est un composé chimique à l’odeur douce, épicée et herbacée, utilisé dans les parfums, les arômes et comme fongicide en agriculture. Cela peut également être un sous-produit de la détérioration du vin.
| Nom UICPA | 4-éthylphénol |
| Formule moléculaire | C8H10O |
| Numero CAS | 104-96-7 |
| Synonymes | p-éthylphénol, 4-hydroxyéthylbenzène, 4-EHP |
| InChI | InChI=1S/C8H10O/c1-7-3-2-6-4-8(7)5-9/h2-5,9H,6H2,1H3 |
Formule 4-éthylphénol
La formule du 4-éthylphénol est C8H10O. La formule donne le nombre et les types d’atomes dans la molécule et est utilisée pour calculer sa masse molaire, son poids moléculaire et d’autres propriétés.
RMN C8H10O
La spectroscopie de résonance magnétique nucléaire (RMN) permet aux scientifiques d’étudier la structure et la composition des molécules. En analysant le spectre RMN C8H10O du 4-éthylphénol, ils peuvent identifier les déplacements chimiques, les constantes de couplage et les intensités maximales qui révèlent des informations sur la structure et la composition de la molécule.
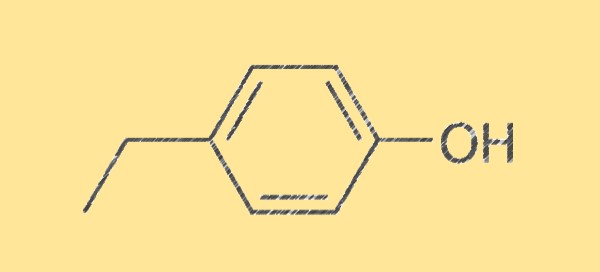
Structure du 4-éthylphénol C8H10O
La structure du 4-éthylphénol est caractérisée par sa formule moléculaire, C8H10O, composée de huit atomes de carbone, dix atomes d’hydrogène et un atome d’oxygène. C’est un liquide incolore à l’odeur sucrée, épicée et herbacée. La molécule est symétrique et possède un groupe hydroxyle (-OH) attaché à un atome de carbone, ce qui en fait un phénol.
Masse molaire du 4-éthylphénol
La masse molaire du 4-éthylphénol est de 134,17 g/mol. La masse molaire est définie comme la masse d’une substance contenant une mole d’entités, telles que des atomes, des molécules ou des ions. Il est calculé en additionnant les masses atomiques de tous les éléments de la molécule. Dans le cas du 4-éthylphénol, sa formule moléculaire (C8H10O) nous donne la masse molaire de 134,17 g/mol.
Point d’ébullition du 4-éthylphénol
Le point d’ébullition du 4-éthylphénol est de 218,7°C. Le point d’ébullition d’une substance est la température à laquelle sa pression de vapeur est égale à la pression atmosphérique et le liquide se transforme en vapeur. Le point d’ébullition du 4-éthylphénol est relativement élevé en raison des forces d’attraction intermoléculaires présentes dans la molécule.
Point de fusion du 4-éthylphénol
Le point de fusion du 4-éthylphénol est de 9,7°C. Le point de fusion d’une substance est la température à laquelle elle passe d’un solide à un liquide. Le point de fusion du 4-éthylphénol est relativement bas en raison de son faible poids moléculaire et de l’absence de forces intermoléculaires fortes.
Densité du 4-éthylphénol g/ml
La densité du 4-éthylphénol est de 1,02 g/mL. La densité d’une substance est définie comme sa masse par unité de volume. Il est calculé en divisant la masse d’un échantillon de substance par son volume. La densité du 4-éthylphénol est relativement faible en raison de son faible poids moléculaire et de l’absence de forces intermoléculaires fortes.
Poids moléculaire du 4-éthylphénol
Le poids moléculaire du 4-éthylphénol est de 134,17 g/mol. Le poids moléculaire est le même que la masse molaire et est calculé en additionnant les masses atomiques de tous les éléments de la molécule. Dans le cas du 4-éthylphénol, sa formule moléculaire (C8H10O) nous donne le poids moléculaire de 134,17 g/mol.
| Apparence | Liquide incolore |
| Gravité spécifique | 1,02 g/ml |
| Couleur | Incolore |
| Odeur | Odeur douce, épicée et herbacée |
| Masse molaire | 134,17 g/mole |
| Densité | 1,02 g/ml |
| Point de fusion | 9,7 °C |
| Point d’ébullition | 218,7°C |
| Point d’éclair | 100°C |
| Solubilité dans l’eau | Soluble |
| Solubilité | Soluble dans les solvants organiques |
| La pression de vapeur | 32 mm Hg (20 °C) |
| Densité de vapeur | 2,4 (air = 1) |
| pKa | 9.5 |
| pH | Neutre |
Sécurité et dangers du 4-éthylphénol
Conservez le 4-éthylphénol à l’écart des sources de chaleur et d’inflammation car c’est un liquide inflammable. Le contact direct peut provoquer une irritation de la peau et des yeux, et l’inhalation de ses vapeurs ou de son brouillard peut entraîner une irritation respiratoire. Protégez-vous en portant des gants de protection, des lunettes de protection et un masque respiratoire lors de la manipulation du 4-éthylphénol. Manipulez-le avec soin et éliminez-le correctement conformément aux réglementations locales.
| Symboles de danger | Liquide inflammable, irritant |
| Description de la sécurité | S2 : Tenir hors de portée des enfants ; S24/25 : Éviter tout contact avec la peau et les yeux ; S36/37/39 : Porter des vêtements de protection appropriés, des gants et une protection des yeux/du visage. |
| Numéros d’identification de l’ONU | UN 1993, Liquide inflammable, NSA (4-éthylphénol) |
| Code SH | 2909.30.90 |
| Classe de danger | 3 |
| Groupe d’emballage | III |
| Toxicité | DL50 orale (rat) = 5 400 mg/kg. Peut provoquer une irritation de la peau et des yeux. L’inhalation de ses vapeurs ou de son brouillard peut provoquer une irritation respiratoire. |
Méthodes de synthèse du 4-éthylphénol
Le 4-éthylphénol est synthétisé par la réaction du phénol avec l’oxyde d’éthylène en présence d’un catalyseur alcalin, tel que l’hydroxyde de sodium ou l’hydroxyde de potassium. La réaction a lieu à une température de 60-80°C et à pression atmosphérique. Le rapport molaire du phénol à l’oxyde d’éthylène varie de 1:1 à 1:2, en fonction du rendement et de la pureté souhaités du 4-éthylphénol. Le mélange réactionnel est ensuite neutralisé et distillé pour obtenir le produit souhaité.
Une méthode de synthèse alternative implique la réaction du 4-chloro-o-crésol avec l’oxyde d’éthylène en présence d’un catalyseur alcalin, tel que l’hydroxyde de sodium ou l’hydroxyde de potassium. La réaction a lieu à une température de 60-80°C et à pression atmosphérique. Le rapport molaire du 4-chloro-o-crésol à l’oxyde d’éthylène varie de 1:1 à 1:2, en fonction du rendement et de la pureté souhaités du 4-éthylphénol. Le mélange réactionnel est ensuite neutralisé et distillé pour obtenir le produit souhaité.
Il est important de noter que les deux méthodes nécessitent un contrôle minutieux de la température, de la pression et de la concentration du catalyseur pour obtenir le rendement et la pureté souhaités en 4-éthylphénol. Le mélange réactionnel doit également être soigneusement surveillé pour détecter la présence d’impuretés, telles que des sous-produits de la réaction ou des contaminants provenant des matières premières, afin de garantir la qualité du produit final.
Utilisations du 4-éthylphénol
Les industries utilisent largement le 4-éthylphénol comme ingrédient de parfum dans les produits de soins personnels et ménagers comme les parfums, les savons, les détergents et les bougies en raison de son odeur douce, épicée et végétale. L’industrie agroalimentaire utilise le 4-éthylphénol comme agent aromatisant dans les bonbons, les produits de boulangerie et les boissons alcoolisées. En tant que précurseur, elle produit également d’autres composés, comme le p-crésol, destinés aux industries pharmaceutique et de chimie fine.
Les fabricants utilisent le 4-éthylphénol dans la production de résines, de plastifiants et d’autres polymères, ainsi que dans la synthèse de caoutchouc et de parfums synthétiques. Les chercheurs étudient également son potentiel en tant qu’agent antifongique en raison de ses effets inhibiteurs sur la croissance fongique.
Des organismes de réglementation tels que l’Union européenne, la Food and Drug Administration des États-Unis et l’International Fragrance Association réglementent l’utilisation du 4-éthylphénol afin de garantir son utilisation sûre et responsable. L’utilisation sûre du 4-éthylphénol nécessite un examen attentif de ses effets potentiels sur la santé et sur l’environnement, ainsi que d’une manipulation et d’un stockage appropriés.
Des questions:
Que sont les éthylphénols ?
Les éthylphénols sont un groupe de composés organiques qui contiennent le groupe fonctionnel phénol et un groupe éthyle (-C2H5) attaché au cycle phénol. Ils sont classés comme alcools aromatiques et ont des propriétés physiques et chimiques différentes selon l’emplacement du groupe éthyle sur le cycle phénol. Parmi les exemples courants d’éthylphénols figurent le 4-éthylphénol et le 2-éthylphénol. Ces composés ont diverses utilisations dans les industries des parfums, de l’alimentation et de la chimie, ainsi que dans la synthèse d’autres produits chimiques. Cependant, l’utilisation des éthylphénols est réglementée en raison de préoccupations concernant leurs effets potentiels sur la santé et l’environnement, et leur utilisation sûre nécessite un examen attentif de leurs exigences en matière de manipulation et de stockage.
Quelle est la structure du composé décrit par les données spectrales ci-dessous ? formule c8h10o
Les données spectrales ne peuvent à elles seules déterminer de manière définitive la structure d’un composé, mais elles peuvent fournir des informations permettant de l’identifier. La formule C8H10O suggère que le composé est un alcool aromatique, ce qui peut être confirmé par la présence d’un groupe fonctionnel alcool, indiqué par un pic OH dans le spectre IR.
Le spectre RMN 1H pourrait fournir des informations sur le nombre et le type d’atomes d’hydrogène dans la molécule, comme la présence d’hydrogènes aromatiques et d’hydrogènes aliphatiques, ainsi que de tout groupe fonctionnel. Le spectre RMN du 13C pourrait également fournir des informations sur le type d’atomes de carbone présents dans la molécule et sur leur environnement.
Sur la base de ces informations, il est possible de déduire la structure du composé, mais des informations et des analyses supplémentaires seraient nécessaires pour la confirmer définitivement. Certaines structures possibles pour un composé de formule C8H10O pourraient inclure le phénol, les crésols ou les xylénols, entre autres.
Selon vous, quelle est la structure du spectre RMN représentée par la formule chimique c8h10o ?
Vous pouvez déterminer la structure probable d’une molécule de formule chimique C8H10O en tant qu’alcool aromatique. Vous vous attendez à voir un signal singulet ou doublet pour le proton hydroxyle et plusieurs pics pour le signal du proton aromatique dans le spectre RMN 1H. Dans le spectre RMN du 13C, vous observez des signaux pour les carbones du cycle aromatique et du groupe carbonyle.
Plusieurs facteurs tels que l’environnement, le solvant et la concentration de la molécule, ainsi que les impuretés ou les isomères, peuvent avoir un impact sur les spectres RMN. Pour déterminer définitivement la structure de la molécule, vous devez analyser et interpréter le spectre RMN réel, même si vous pouvez faire une prédiction basée sur la formule chimique.
Comment calculer les degrés d’insaturation de c8h10o ?
Les degrés d’insaturation d’une molécule peuvent être calculés à l’aide de la formule :
Degrés d’insaturation = (2 + nombre d’anneaux) + (nombre de doubles liaisons / 2)
La molécule de formule C8H10O possède un seul cycle car c’est un cycle aromatique. La molécule n’a pas de doubles liaisons car c’est un alcool et ne contient pas de doubles liaisons.
Par conséquent, les degrés d’insaturation pour C8H10O seraient calculés comme suit :
Degrés d’insaturation = (2 + 1) + (0/2) = 3
Ce résultat indique que la molécule C8H10O possède trois degrés d’insaturation et est donc susceptible d’être un alcool aromatique. Le calcul des degrés d’insaturation constitue un moyen rapide et pratique d’estimer la structure moléculaire d’un composé et d’identifier s’il contient des groupes fonctionnels ou des cycles insaturés. Il convient toutefois de noter que cette méthode présente certaines limites et ne convient pas à tous les composés.
Qu’est-ce que c8h10o ?
C8H10O est la formule chimique d’une molécule contenant 8 atomes de carbone, 10 atomes d’hydrogène et 1 atome d’oxygène. La molécule peut être l’un des nombreux composés chimiques différents, notamment des alcools aromatiques tels que le phénol, les crésols ou les xylénols, entre autres.
Des techniques telles que la spectroscopie infrarouge, la spectroscopie de résonance magnétique nucléaire ou la spectrométrie de masse déterminent l’identité réelle de la molécule en fonction de sa structure moléculaire et de ses propriétés.
