Le benzile ou C14H10O2 est un composé organique cristallin jaune utilisé comme précurseur dans la synthèse des colorants et comme photoinitiateur dans la chimie des polymères. Il peut également agir comme agent réducteur et constitue un intermédiaire dans la formation de l’acide benzilique.
| Nom UICPA | 1,2-diphényl-1,2-dicarboxyéthylène |
| Formule moléculaire | C14H10O2 |
| Numero CAS | 134-81-6 |
| Synonymes | 1,2-Diphényl-1,2-propanedione, 1,2-Diphényléthanedione, Benzilum, Benzil |
| InChI | InChI=1S/C14H10O2/c15-13(14(16)17)11-6-8-12(9-7-11)10-5-3-1-2-4-6/h1-9H,10- 17H2 |
Benzile Poids moléculaire
Le poids moléculaire du benzil est de 210,24 g/mol. C’est la somme des masses atomiques de tous les atomes d’une molécule de benzile. Le poids moléculaire du benzil est calculé sur la base de sa formule moléculaire, C14H10O2.
Benzile Densité g/mL
La densité du benzil est de 1,20 g/mL. C’est la mesure de la masse par unité de volume d’une substance. La densité du benzil est relativement faible, ce qui le rend plus facile à manipuler par rapport à d’autres substances de densité plus élevée.
Point d’ébullition du benzyle
Le point d’ébullition du benzil est de 350°C (662°F). C’est la température à laquelle la pression de vapeur d’un liquide est égale à la pression atmosphérique et le liquide se transforme en vapeur. Le point d’ébullition d’une substance dépend de divers facteurs tels que la pression, le poids moléculaire et les forces intermoléculaires.
Benzil Point de fusion
Le point de fusion du benzil est de 98°C (270°F). C’est la température à laquelle un solide se transforme en liquide. Le point de fusion du benzil est relativement bas, ce qui en fait un intermédiaire utile dans les synthèses organiques.
Benzile Masse molaire
La masse molaire de C14H10O2 est de 210,24 g/mol. C’est la quantité de substance qui contient le même nombre d’entités (par exemple des atomes, des molécules, des ions) que le nombre d’entités contenues dans 12 grammes de carbone 12 pur. La masse molaire du benzil est calculée sur la base de sa formule moléculaire, C14H10O2.
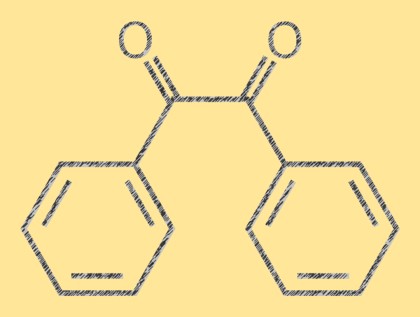
Structure du benzyle
Le benzile est un composé organique cristallin jaune dont la formule moléculaire est C14H10O2. C’est une dicétone composée de deux groupes phényle attachés à une double liaison centrale carbone-carbone. La molécule est plane et la double liaison est plane. La molécule de benzile a une couleur jaune vif caractéristique qui la rend utile comme composé de référence en chimie analytique.
Formule Benzile
La formule chimique du benzile est C14H10O2. Il représente les éléments constitutifs du benzil et leurs ratios relatifs. La formule montre que le benzile est constitué de 14 atomes de carbone, 12 atomes d’hydrogène et 2 atomes d’oxygène.
RMN du benzile
Le C14H10O2 peut être analysé par spectroscopie de résonance magnétique nucléaire (RMN). La spectroscopie RMN est un outil puissant qui fournit des informations sur la structure chimique et les interactions des molécules. En spectroscopie RMN, les propriétés magnétiques du noyau sont utilisées pour déterminer l’environnement chimique du noyau et pour obtenir des informations sur la liaison et les déplacements chimiques de la molécule. Le spectre RMN du C14H10O2 fournit des informations sur le nombre de protons dans la molécule et l’environnement chimique de chaque proton, ce qui permet de confirmer la structure du C14H10O2.
| Apparence | Solide cristallin jaune |
| Gravité spécifique | 1,20 g/ml |
| Couleur | Jaune |
| Odeur | Inodore |
| Masse molaire | 210,24 g/mole |
| Densité | 1,20 g/ml |
| Point de fusion | 94,8°C |
| Point d’ébullition | 350°C (662°F) |
| Point d’éclair | Pas disponible |
| Solubilité dans l’eau | Légèrement soluble dans l’eau |
| Solubilité | Soluble dans l’éthanol et l’éther |
| La pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | Pas disponible |
| pH | Pas disponible |
Sécurité et dangers du benzyle
Le C14H10O2 est considéré comme une substance modérément toxique et doit être manipulé avec précaution. Il est hautement inflammable et doit être conservé à l’écart des sources de chaleur et des étincelles. L’inhalation de vapeurs de C14H10O2 peut provoquer une irritation des yeux, du nez et de la gorge, ainsi que des problèmes respiratoires. Le contact cutané avec le C14H10O2 peut provoquer une irritation cutanée et des rougeurs. L’ingestion de C14H10O2 peut provoquer une irritation de l’estomac et des problèmes digestifs. S’il est ingéré en grande quantité, il peut entraîner des problèmes de santé plus graves tels que des vomissements, des étourdissements et une perte de conscience. Il est important de porter des gants de protection et des lunettes de protection lors de la manipulation du C14H10O2 et de travailler dans un endroit bien ventilé pour minimiser l’exposition. Si des effets indésirables surviennent après un contact avec le C14H10O2, il est recommandé de consulter immédiatement un médecin.
| Symboles de danger | Inflammable |
| Description de la sécurité | S24/25 – Éviter tout contact avec la peau et les yeux |
| Numéros d’identification de l’ONU | UN2024 – Marchandises dangereuses, classe de danger 3 |
| Code SH | 2915.90.90 |
| Classe de danger | 3 – Liquides inflammables |
| Groupe d’emballage | III – Risque modéré |
| Toxicité | Modérément toxique |
Méthodes de synthèse du benzile
Le C14H10O2 peut être synthétisé par diverses méthodes, notamment les suivantes :
- Oxydation du diphénylméthanol : Le diphénylméthanol est oxydé à l’aide de trioxyde de chrome pour former C14H10O2. Il s’agit d’une méthode couramment utilisée dans la synthèse du C14H10O2 car elle est simple et rentable.
- Oxydation Wacker : Cette méthode implique l’utilisation d’un catalyseur au palladium et d’un oxydant hydroperoxyde pour convertir l’alcène en C14H10O2. La réaction est généralement réalisée en présence d’un solvant, tel que l’éthanol ou l’eau.
- Condensation de Knoevenagel : Dans cette méthode, le C14H10O2 est synthétisé par une réaction entre le benzaldéhyde et l’acide barbiturique en présence d’une base forte telle que l’hydroxyde de sodium ou l’hydroxyde de potassium.
- Réaction d’Ullmann : Cette méthode implique le couplage de deux composés aromatiques par une réaction catalysée par le cuivre. Dans la synthèse du C14H10O2, deux molécules de benzaldéhyde réagissent pour former du C14H10O2.
- Oxydation Baeyer-Villiger : Dans cette méthode, le C14H10O2 est synthétisé en oxydant la cyclohexanone en C14H10O2 en présence d’un oxydant peroxyacide et d’une quantité catalytique d’une amine tertiaire.
Le choix de la méthode de synthèse du C14H10O2 dépend de divers facteurs, notamment la disponibilité des matières premières, le rendement et la pureté souhaités du produit, ainsi que le coût et le temps impliqués dans le processus de synthèse.
Utilisations du benzyle
Le C14H10O2 est un produit chimique polyvalent qui a de nombreuses utilisations dans divers domaines. Certaines des utilisations courantes du C14H10O2 sont :
- La production de produits chimiques fins utilise le C14H10O2 comme matière première dans la production de divers produits chimiques fins, notamment des antioxydants, des retardateurs de flamme et des colorants.
- La synthèse des polymères utilise le C14H10O2 dans la synthèse de polymères, notamment de polycarbonates et de polyuréthanes, avec une large gamme d’applications dans diverses industries.
- Les pesticides utilisent le C14H10O2 comme intermédiaire dans la synthèse de certains pesticides pour lutter contre les ravageurs des cultures et des jardins.
- Les cosmétiques utilisent le C14H10O2 comme parfum dans certains produits cosmétiques tels que les parfums et les eaux de Cologne pour fournir un arôme frais et floral.
- L’industrie des arômes et des parfums utilise le C14H10O2 comme ingrédient d’arôme et de parfum pour conférer un arôme boisé et floral aux produits alimentaires et cosmétiques.
En conclusion, le C14H10O2 est un produit chimique polyvalent qui a un large éventail d’utilisations dans diverses industries, notamment les industries de la chimie fine, de la pharmacie et des cosmétiques.
Des questions:
Le benzil est-il polaire ?
Oui, C14H10O2 est polaire. Il a une structure moléculaire polaire en raison de la présence de groupes fonctionnels polaires, tels que les groupes carbonyle (-C=O) et phényle (-C6H5). Cette structure polaire rend le C14H10O2 soluble dans les solvants polaires, tels que l’eau et les alcools, mais insoluble dans les solvants non polaires, tels que les hydrocarbures. La nature polaire du C14H10O2 lui permet également de participer à diverses réactions polaires, telles que les liaisons hydrogène et les interactions dipôle-dipôle.
À quel type de réaction se produit la formation d’acide benzilique ?
La formation d’acide C14H10O2ique à partir de C14H10O2 est un type de réaction de réarrangement connu sous le nom de réarrangement de l’acide benzilique. Cette réaction est un réarrangement du groupe carbonyle dans C14H10O2 pour former un nouveau groupe fonctionnel acide carboxylique dans l’acide benzilique. Le réarrangement de l’acide benzilique est un exemple de réarrangement de Beckmann, qui est un type de réaction de substitution nucléophile impliquant le réarrangement de cétones cycliques en amides ou en acides carboxyliques. Le mécanisme réactionnel implique la formation d’un intermédiaire cyclique, suivie de la migration du groupe carbonyle et de l’élimination d’un groupe partant.
