2 La butanone, également connue sous le nom de méthyléthylcétone ou MEK, est un liquide incolore et inflammable avec une odeur sucrée et fruitée. Il est couramment utilisé comme solvant dans diverses applications industrielles et domestiques.
| Nom UICPA | 2-Butanone |
| Formule moléculaire | C4H8O |
| Numero CAS | 78-93-3 |
| Synonymes | Méthyléthylcétone (MEK), butan-2-one, 2-butanone, 3-oxobutan-2-one |
| InChI | InChI=1S/C4H8O/c1-3-4-5-2/h3-4H,1-2H3 |
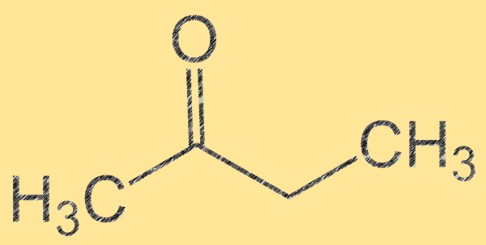
Structure du butanone
La butanone a une formule moléculaire de C4H8O et sa structure moléculaire peut être représentée par CH3C(O)CH2CH3. C’est un liquide incolore et inflammable à l’odeur sucrée et fruitée. La butanone est une cétone, ce qui signifie qu’elle contient un groupe carbonyle (C=O) lié à un atome de carbone. Ce groupe carbonyle fait de la butanone un intermédiaire important dans la synthèse de divers composés organiques.
2-Butanone Masse molaire
La butanone, également connue sous le nom de méthyléthylcétone (MEK), a une masse molaire de 72,11 g/mol. Il s’agit de la quantité de substance contenue dans un échantillon donné de butanone, exprimée en grammes par mole. La masse molaire est une propriété importante de la butanone qui est utilisée dans divers calculs et expériences en chimie, par exemple pour déterminer la masse d’une substance nécessaire pour réagir avec une autre substance dans un rapport molaire spécifique. La masse molaire de la butanone peut également être utilisée pour convertir sa masse en moles, ce qui est utile dans de nombreuses applications, notamment les réactions chimiques, la synthèse chimique et la chimie analytique.
Point d’ébullition de MEK
Le point d’ébullition de la MEK est de 80,6 °C (176,5 °F). C’est la température à laquelle la MEK passe de l’état liquide à l’état gazeux. Le point d’ébullition est une propriété importante de la MEK car elle affecte sa capacité à s’évaporer et à former une vapeur. Par exemple, dans certaines applications, la MEK est utilisée comme solvant et il est souhaitable qu’elle s’évapore rapidement afin que le soluté puisse être éliminé. Dans d’autres applications, il est souhaitable que la MEK reste sous sa forme liquide, afin de pouvoir être utilisée comme solvant pour les réactions effectuées à son point d’ébullition ou en dessous.
MEK Point de fusion
Le point de fusion de la MEK est de -93,9 °C (-136,0 °F). C’est la température à laquelle la MEK passe de l’état solide à l’état liquide. Le point de fusion est une propriété importante de la MEK car elle affecte sa capacité à être utilisée comme solvant pour les substances solides. Par exemple, la MEK peut être utilisée comme solvant pour certains solides dont le point de fusion est inférieur à son propre point de fusion, tels que les graisses, les cires et les résines.
Densité MEK g/mL
La densité de MEK est de 0,80 g/mL. Il s’agit de la masse par unité de volume de MEK et constitue une propriété importante utilisée dans de nombreuses applications, notamment le calcul de la quantité de MEK requise pour un volume spécifique. La densité de MEK est également utilisée pour calculer son volume molaire, qui est le volume occupé par une mole de MEK. Ces informations sont utiles dans diverses expériences, notamment pour déterminer la masse molaire d’une substance.
MEK Poids moléculaire
Le poids moléculaire de la MEK est de 72,11 g/mol. Il s’agit de la somme des poids atomiques des atomes d’une molécule de MEK et constitue une propriété importante utilisée dans de nombreuses applications, notamment le calcul de la masse molaire d’une substance. Le poids moléculaire de la MEK peut être utilisé pour convertir sa masse en moles, ce qui est utile dans de nombreuses applications, notamment les réactions chimiques, la synthèse chimique et la chimie analytique.
Formule MEK
La formule chimique de la MEK est C4H8O. Cette formule représente les proportions relatives.
| Apparence | Liquide incolore |
| Gravité spécifique | 0,79 – 0,80 |
| Couleur | Incolore |
| Odeur | Doux, fruité |
| Masse molaire | 72,11 g/mole |
| Densité | 0,79 – 0,80 g/mL |
| Point de fusion | -93,9 °C (-136,0 °F) |
| Point d’ébullition | 80,6 °C (176,5 °F) |
| Point d’éclair | 12 °C (53,6 °F) |
| Solubilité dans l’eau | Soluble |
| Solubilité | Soluble dans la plupart des solvants organiques |
| Pression de vapeur | 38 mmHg (20 °C) |
| Densité de vapeur | 2,3 (air = 1) |
| pKa | 20.2 |
| pH | 7 (neutre) |
Remarque : Les valeurs fournies dans ce tableau sont approximatives et peuvent varier légèrement en fonction de la source et des conditions de mesure.
Sécurité et dangers du butanone
La butanone, également connue sous le nom de méthyléthylcétone, est un liquide inflammable et volatil qui peut provoquer une irritation de la peau, des yeux et des voies respiratoires s’il n’est pas manipulé avec les mesures de sécurité appropriées. L’inhalation de concentrations élevées de butanone peut provoquer des maux de tête, des étourdissements, des nausées et une perte de conscience. Une exposition prolongée à de faibles concentrations de butanone peut provoquer des lésions rénales et hépatiques. Il est également hautement inflammable et peut s’enflammer facilement, ce qui présente un risque d’incendie. Lors de l’utilisation de butanone, il est important de travailler dans un endroit bien ventilé, de porter des vêtements et des lunettes de protection et d’éviter tout contact avec la peau. En cas de contact avec la peau ou les yeux, rincer immédiatement à l’eau et consulter un médecin si nécessaire. En cas d’ingestion, ne pas faire vomir et consulter immédiatement un médecin. La butanone doit être conservée dans un endroit frais, sec et bien ventilé, à l’écart des sources de chaleur et des flammes.
| Symboles de danger | Liquide inflammable, Irritant |
| Description de la sécurité | S2 – Tenir hors de portée des enfants<br>S16 – Tenir à l’écart des sources d’ignition<br>S24/25 – Eviter tout contact avec la peau et les yeux<br>S26 – En cas de contact avec les yeux, rincer immédiatement et abondamment à l’eau et demander un avis médical |
| Identifiants ONU | UN1090 |
| Code SH | 29141100 |
| Classe de danger | 3 (Liquide inflammable) |
| Groupe d’emballage | II |
| Toxicité | DL50 (orale, rat) – 4 220 mg/kg |
Méthodes de synthèse du butanone
La butanone peut être synthétisée par plusieurs méthodes, notamment l’oxydation directe du 2-butanol et la condensation aldolique de l’acétone et du 2-propanol.
La méthode d’oxydation directe implique la réaction du 2-butanol avec un agent oxydant tel que l’acide chromique, le peroxyde d’hydrogène ou un mélange d’acide nitrique et d’acide sulfurique. La réaction se déroule dans un environnement acide et la méthyléthylcétone résultante est séparée du mélange réactionnel par distillation.
La méthode de condensation aldol implique la réaction de l’acétone avec le 2-propanol en présence d’une base forte telle que l’hydroxyde de sodium ou l’hydroxyde de potassium. La réaction produit un mélange de méthyléthylcétone et d’autres sous-produits, qui sont séparés par distillation.
Une autre méthode de synthèse implique la réaction de l’acétone avec le formaldéhyde en présence d’un catalyseur tel que l’acide sulfurique ou l’acide p-toluènesulfonique. Cette réaction produit un mélange de méthyléthylcétone, de formaldéhyde et d’autres sous-produits, qui sont séparés par distillation.
Dans l’ensemble, la synthèse de la méthyléthylcétone nécessite un contrôle minutieux des conditions de réaction pour garantir la production d’un produit de haute qualité avec un minimum de sous-produits. Il est important de suivre les précautions de sécurité appropriées lorsque vous travaillez avec les produits chimiques et les réactions impliqués dans la synthèse de la méthyléthylcétone.
Utilisations du butanone
La butanone, également connue sous le nom de méthyléthylcétone, a un large éventail d’utilisations industrielles en raison de sa solvabilité, de sa volatilité et de son faible point d’ébullition. Certaines des utilisations les plus courantes de la butanone comprennent :
- Solvant : La méthyléthylcétone sert de solvant à diverses substances telles que les résines, les adhésifs, les encres, les décapants pour peinture, les encres d’imprimerie, les laques nitrocellulosiques et les caoutchoucs synthétiques.
- Agent de nettoyage : L’industrie électronique l’utilise comme agent de nettoyage pour nettoyer les pièces et surfaces métalliques de la graisse, de l’huile et d’autres contaminants.
- Produits pharmaceutiques : Dans l’industrie pharmaceutique, la méthyléthylcétone sert de solvant dans la production de vaccins, d’antibiotiques et d’autres médicaments.
- Revêtements : Les revêtements pour le bois, le papier et d’autres matériaux utilisent également de la méthyléthylcétone comme solvant dans leur production, ainsi que dans la fabrication de vernis, laques et autres revêtements protecteurs.
- Parfums : Les industries cosmétiques et alimentaires utilisent la méthyléthylcétone comme solvant pour les parfums et les arômes.
- Adhésifs : les adhésifs et les produits d’étanchéité utilisent également de la méthyléthylcétone comme solvant dans leur production.
En plus de ses utilisations industrielles, la méthyléthylcétone a également été étudiée pour son potentiel en tant que carburant. Son contenu énergétique élevé et sa faible toxicité par rapport aux autres carburants en font une source d’énergie alternative prometteuse.
Des questions:
Que donnera la réaction suivante ? 2-butanone + catalyseur h2/ni
La réaction de la 2-butanone avec l’hydrogène gazeux sur un catalyseur au nickel est connue sous le nom de réaction d’hydrogénation. Cette réaction donnera le produit suivant :
2-butanone + H2 -> 2-butanol
La réduction de la double liaison entre les atomes de carbone et d’oxygène dans le groupe cétone de la 2-butanone entraîne la formation de 2-butanol par activation de l’hydrogène gazeux par un catalyseur au nickel. L’industrie chimique utilise couramment cette réaction pour produire du 2-butanol, un solvant précieux et une matière première pour d’autres productions chimiques. Un contrôle minutieux de la température, de la pression et du type de catalyseur est nécessaire pour une hydrogénation efficace et sélective du 2-butanone en 2-butanol.
La 2 butanone est-elle une cétone ?
La chimie organique caractérise la 2-butanone, également connue sous le nom de méthyléthylcétone, comme un type de cétone avec un groupe carbonyle (C=O) lié à un atome de carbone au sein d’une chaîne hydrocarbonée. Le groupe carbonyle de la 2-butanone réside entre deux atomes de carbone, d’où son étiquette de « méthyléthylcétone ».
Quel est le spectre infrarouge du 2-butanone ?
Le spectre IR (infrarouge) de la 2-butanone (également connue sous le nom de méthyléthylcétone) peut fournir des informations importantes sur sa structure moléculaire et ses groupes fonctionnels. Le spectre IR de la 2-butanone montre généralement les principales bandes d’absorption suivantes :
- Étirement du carbonyle : Cette bande apparaît sous la forme d’un pic net entre 1 700 et 1 700 cm^-1 et est caractéristique du groupe fonctionnel C=O de la cétone.
- Étirement alkyle : Les pics entre 2900 et 3000 cm^-1 correspondent aux vibrations d’étirement des groupes CH2 et CH3 dans la 2-butanone.
- Flexion CH : Les pics entre 1400 et 1500 cm^-1 correspondent aux vibrations de flexion des liaisons CH dans la 2-butanone.
- Flexion COC : Le pic entre 1300 et 1400 cm^-1 correspond aux vibrations de flexion du groupe COC dans la 2-butanone.
Il est important de noter que le spectre IR de la 2-butanone sera influencé par la préparation de l’échantillon et les instruments utilisés, ainsi que par la présence d’impuretés ou de contaminants.
