Le dioxyde de chlore ou ClO2 est un agent de blanchiment très efficace et à action rapide utilisé dans le traitement de l’eau et la conservation des aliments. C’est un gaz vert jaunâtre avec une odeur âcre.
| Nom UICPA | Dioxyde de chlore |
| Formule moléculaire | ClO2 |
| Numero CAS | 10049-04-4 |
| Synonymes | Peroxyde de chlore, ClO2, oxyde de chlore (IV) |
| InChI | InChI=1S/ClO2/c2-1-3 |
Formule de dioxyde de chlore
La formule du dioxyde de chlore est ClO2. C’est un gaz hautement réactif composé d’un atome de chlore et de deux atomes d’oxygène. La formule du dioxyde de chlore reflète sa structure moléculaire, ce qui est crucial pour comprendre ses propriétés physiques et chimiques, notamment sa réactivité, sa stabilité et sa solubilité.
ClO2 Masse molaire
ClO2 a une masse molaire de 67,45 g/mol. C’est un agent oxydant très réactif, connu pour ses fortes propriétés blanchissantes. Le ClO2 est largement utilisé comme désinfectant et assainissant dans diverses applications industrielles et domestiques, notamment le traitement de l’eau, le blanchiment du papier et la conservation des aliments. La masse molaire d’une substance joue un rôle crucial dans la détermination de ses propriétés physiques et chimiques, notamment sa densité, son point d’ébullition et sa solubilité.
Point d’ébullition du ClO2
Le point d’ébullition du ClO2 est de 11,3°C (52,3°F). Le ClO2 existe sous forme de gaz vert jaunâtre à température et pression standard. Il a une odeur âcre et est très réactif, ce qui en fait un excellent agent oxydant. Le point d’ébullition d’une substance est une propriété physique importante qui aide à déterminer sa stabilité, sa volatilité et sa transportabilité.
ClO2 Point de fusion
Le point de fusion du ClO2 est de -51,5°C (-60,7°F). En tant que gaz à température et pression standard, il n’a pas d’état solide. Le ClO2 est hautement soluble dans l’eau et est couramment utilisé comme désinfectant et assainissant dans les applications de traitement de l’eau et de conservation des aliments. Le point de fusion d’une substance est une propriété importante qui peut affecter son comportement physique et chimique, notamment dans les réactions impliquant un changement d’état.
ClO2 Densité g/ml
La densité du ClO2 est de 1,97 g/mL à température et pression standard. C’est un gaz hautement réactif qui est couramment utilisé comme agent de blanchiment et d’assainissement dans diverses applications industrielles. La densité d’une substance est une propriété physique importante qui peut affecter son comportement dans divers processus, notamment le transport, le stockage et la manipulation.
ClO2 Poids moléculaire
Le poids moléculaire du ClO2 est de 67,45 g/mol. C’est un agent oxydant largement utilisé dans les applications de traitement de l’eau, de blanchiment du papier et de conservation des aliments. Le poids moléculaire d’une substance est une propriété importante qui affecte son comportement physique et chimique, notamment sa densité, son point d’ébullition et sa solubilité.
Structure du ClO2
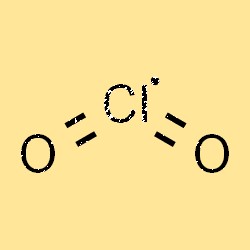
La structure du ClO2 est représentée par la formule moléculaire ClO2. C’est un gaz hautement réactif composé d’un atome de chlore et de deux atomes d’oxygène. La molécule a une forme courbée et est de nature polaire, ce qui signifie qu’elle a une extrémité positive et une extrémité négative. La structure du ClO2 joue un rôle crucial dans sa réactivité chimique, sa stabilité et sa solubilité dans divers solvants.
| Apparence | Gaz vert jaunâtre |
| Gravité spécifique | 1,97 g/ml |
| Couleur | Vert jaunâtre |
| Odeur | Âcre |
| Masse molaire | 67,45 g/mole |
| Densité | 1,97 g/ml |
| Point de fusion | -51,5°C (-60,7°F) |
| Point d’ébullition | 11,3°C (52,3°F) |
| Point d’éclair | Sans objet (gaz) |
| Solubilité dans l’eau | Très soluble |
| Solubilité | Soluble dans l’eau et les solvants organiques |
| Pression de vapeur | Non spécifié |
| Densité de vapeur | Non spécifié |
| pKa | Non spécifié |
| pH | Non spécifié |
Remarque Certaines des valeurs répertoriées sont des estimations basées sur les données disponibles. Il est toujours préférable de consulter une source fiable pour obtenir des informations spécifiques et précises sur les propriétés d’une substance.
Sécurité et dangers du dioxyde de chlore
Le ClO2 est une substance hautement réactive et toxique qui peut présenter des risques importants pour la santé et la sécurité si elle n’est pas manipulée correctement. L’exposition à des concentrations élevées de gaz ClO2 peut provoquer une irritation des yeux, du nez et de la gorge, ainsi que des problèmes respiratoires et des difficultés respiratoires. L’ingestion de ClO2 peut provoquer de graves troubles digestifs, notamment des nausées, des vomissements et de la diarrhée. Le contact cutané avec le ClO2 peut provoquer des irritations et des brûlures chimiques. De plus, le ClO2 est inflammable et peut s’enflammer en présence de chaleur ou d’étincelles. Pour minimiser les risques associés au ClO2, il est important d’utiliser un équipement de protection individuelle approprié lors de sa manipulation, comme des gants, des lunettes de protection et un masque respiratoire. Il est également important de suivre des pratiques sûres de stockage et de manipulation pour éviter les rejets de ClO2 dans l’environnement.
| Symboles de danger | Agent comburant, Toxique |
| Description de la sécurité | S2- Tenir hors de portée des enfants. S22- Ne pas respirer les poussières. S26- En cas de contact avec les yeux, rincer immédiatement et abondamment à l’eau et consulter un médecin. |
| Identifiants ONU | ONU 1479 |
| Code SH | 2828.90.90 |
| Classe de danger | 5.1 |
| Groupe d’emballage | III |
| Toxicité | Le dioxyde de chlore est hautement toxique lorsqu’il est inhalé, ingéré ou entre en contact avec la peau. Cela peut provoquer une détresse respiratoire, une détresse digestive, une irritation des yeux et des brûlures chimiques. |
Méthodes de synthèse du dioxyde de chlore
Le ClO2 est généralement synthétisé par deux méthodes principales : le processus chlorate-chlorite et le processus d’électrolyse.
Le procédé chlorate-chlorite implique la réaction du chlorate de sodium avec un acide, tel que l’acide sulfurique, pour produire du ClO2. Ce processus peut être réalisé à l’échelle industrielle et est couramment utilisé pour la production de ClO2 destiné au traitement de l’eau et à d’autres applications.
Le processus d’électrolyse implique l’utilisation d’un courant électrique pour générer du ClO2. Ce processus est généralement effectué en laboratoire et est utilisé pour la production de petites quantités de ClO2 à des fins de recherche et d’expérimentation.
Quelle que soit la méthode de synthèse utilisée, il est important de suivre les protocoles de sécurité appropriés et d’utiliser un équipement de protection approprié lors de la manipulation du ClO2. Cela comprend le port de gants, de protections oculaires et d’un masque respiratoire pour éviter l’exposition au gaz hautement toxique.
En plus de ces méthodes, le dioxyde de chlore peut également être généré par la réaction du chlorite de sodium avec un acide ou par la réaction du chlorate de sodium avec l’acide chlorhydrique. Le choix de la méthode de synthèse dépendra de l’application spécifique et des propriétés souhaitées du produit final.
Utilisations du dioxyde de chlore
Le dioxyde de chlore est un produit chimique polyvalent avec un large éventail d’applications, notamment le traitement de l’eau, la conservation des aliments et le blanchiment. Certaines des utilisations les plus courantes du dioxyde de chlore comprennent
Le dioxyde de chlore pour le traitement de l’eau est couramment utilisé comme désinfectant dans le traitement de l’eau potable, des eaux usées et des eaux de procédés industriels. Il est très efficace contre un large éventail d’agents pathogènes, notamment les bactéries, les virus et les parasites, et est souvent utilisé comme alternative au chlore ou à l’ozone.
Le dioxyde de chlore pour la conservation des aliments est utilisé comme agent antimicrobien dans la conservation des fruits, légumes, viandes et autres produits alimentaires. Il est efficace contre une variété de micro-organismes, notamment les bactéries, les levures et les moisissures, et contribue à prolonger la durée de conservation des produits alimentaires.
Le dioxyde de chlore est utilisé pour blanchir la pâte de bois et d’autres fibres afin de produire des couleurs vives et uniformes. Il est également utilisé dans le blanchiment des textiles, comme le coton et la laine, pour éliminer les impuretés et améliorer la blancheur.
Autres utilisations Le dioxyde de chlore est également utilisé dans le traitement des déchets industriels et municipaux, ainsi que dans la production d’autres produits chimiques, tels que les chlorates, les chloramines et d’autres désinfectants. Dans toutes ses applications, le dioxyde de chlore est très efficace et offre de nombreux avantages par rapport aux autres traitements chimiques. Cependant, il est important de faire preuve de prudence lors de la manipulation et de l’utilisation du dioxyde de chlore, car il s’agit d’une substance hautement réactive et toxique qui peut présenter des risques importants pour la santé et la sécurité si elle n’est pas manipulée correctement.
