Le méthoxybenzène, également connu sous le nom d’anisole, est un composé aromatique avec un groupe méthoxy (-OCH3) attaché à un cycle benzénique. Il est couramment utilisé comme solvant et agent aromatisant.
| Nom UICPA | Méthoxybenzène |
| Formule moléculaire | C7H8O |
| Numero CAS | 100-66-3 |
| Synonymes | Anisole, méthoxybenzène, méthylanisole, méthylphényléther, phénoxyméthane, alcool anisylique, anisole, phénylméthyléther |
| InChI | InChI=1S/C7H8O/c1-8-7-5-3-2-4-6-7/h2-6H,1H3 |
Densité d’anisole g/ml
Le méthoxybenzène a une densité de 0,995 g/mL à température ambiante. La densité est la masse d’une substance par unité de volume et constitue une propriété physique importante pour déterminer la pureté et la concentration d’un échantillon. Le méthoxybenzène est moins dense que l’eau, qui a une densité de 1 g/mL, et légèrement moins dense que le benzène (0,879 g/mL).
Masse molaire du méthoxybenzène
Le méthoxybenzène a une masse molaire de 108,14 g/mol. La masse molaire est la masse d’une mole d’une substance et est calculée en additionnant les poids atomiques de tous les atomes de la molécule. Dans le méthoxybenzène, la formule moléculaire est C7H8O, qui contient un total de 7 atomes de carbone, 8 atomes d’hydrogène et 1 atome d’oxygène. La masse molaire du méthoxybenzène est utile pour calculer la quantité de substance dans un échantillon donné, ainsi que pour la conversion entre moles, masse et volume.
Point d’ébullition du méthoxybenzène
Le méthoxybenzène a un point d’ébullition de 154,2 °C (309,6 °F). Le point d’ébullition est la température à laquelle la pression de vapeur d’un liquide est égale à la pression externe, permettant au liquide de se transformer en gaz. Le méthoxybenzène est un liquide relativement volatil, ce qui signifie qu’il s’évapore facilement à température ambiante. Son point d’ébullition est supérieur à celui du benzène (80,1 °C) en raison de la présence du groupe méthoxy (-OCH3), qui augmente les forces intermoléculaires entre les molécules.
Point de fusion du méthoxybenzène
Le méthoxybenzène a un point de fusion de -37,5 °C (-35,5 °F). Le point de fusion est la température à laquelle une substance solide passe à l’état liquide. Le méthoxybenzène est un liquide incolore à température ambiante, mais il peut se solidifier à basse température. La présence du groupe méthoxy abaisse le point de fusion du méthoxybenzène par rapport au benzène, qui a un point de fusion de 5,5 °C.
Poids moléculaire du méthoxybenzène
Le méthoxybenzène a un poids moléculaire de 108,14 g/mol. Le poids moléculaire est la somme des poids atomiques de tous les atomes d’une molécule. C’est un paramètre utile pour calculer la stœchiométrie des réactions chimiques et pour la conversion entre moles, masse et volume.
Structure du méthoxybenzène
Le méthoxybenzène a une structure constituée d’un cycle benzénique avec un groupe méthoxy (-OCH3) attaché à l’un des atomes de carbone. Le groupe méthoxy est un groupe méthyle (-CH3) lié à un atome d’oxygène (-O), qui à son tour est lié au cycle benzène. Le méthoxybenzène est un composé aromatique, ce qui signifie qu’il a une structure plane et cyclique avec une alternance de liaisons simples et doubles.
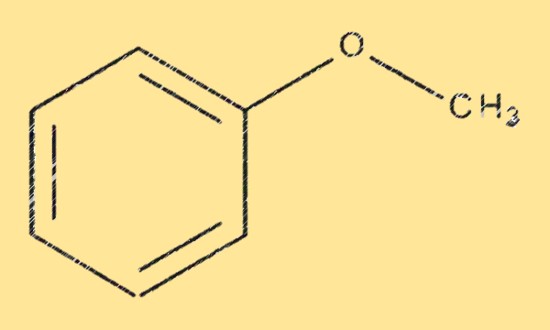
Formule de méthoxybenzène
Le méthoxybenzène a une formule moléculaire C7H8O, qui indique le nombre et les types d’atomes dans la molécule. La formule peut être utilisée pour calculer la masse molaire, la densité et d’autres propriétés physiques du méthoxybenzène. En plus de sa formule moléculaire, le méthoxybenzène est également connu sous plusieurs noms communs et synonymes, notamment anisole, méthylphényléther et phénoxyméthane.
| Apparence | Liquide incolore |
| Gravité spécifique | 0,995 g/ml |
| Couleur | Incolore |
| Odeur | Aromatique, doux, agréable |
| Masse molaire | 108,14 g/mole |
| Densité | 0,995 g/ml |
| Point de fusion | -37,5 °C (-35,5 °F) |
| Point d’ébullition | 154,2 °C (309,6 °F) |
| Point d’éclair | 58 °C (136,4 °F) |
| Solubilité dans l’eau | 1,41 g/L à 20 °C |
| Solubilité | Miscible dans l’alcool, l’éther, le benzène, le chloroforme |
| Pression de vapeur | 1,44 mmHg à 25 °C |
| Densité de vapeur | 3,74 (air = 1) |
| pKa | 17 |
| pH | N’est pas applicable |
Sécurité et dangers du méthoxybenzène
Le méthoxybenzène, également connu sous le nom d’anisole, est généralement considéré comme une substance présentant un risque faible à modéré. Cependant, il peut provoquer une irritation des yeux, de la peau et du système respiratoire en cas d’exposition. Le méthoxybenzène est également inflammable et peut s’enflammer s’il est exposé à la chaleur ou à une source d’inflammation. Il peut également émettre des fumées toxiques lorsqu’il est brûlé. Une exposition à long terme au méthoxybenzène peut provoquer des lésions hépatiques et rénales. Il est important de suivre les précautions de sécurité appropriées lors de la manipulation ou du travail avec le méthoxybenzène, notamment en portant un équipement de protection approprié et en le stockant dans un endroit frais, sec et bien ventilé, à l’écart des sources de chaleur et d’inflammation.
| Symboles de danger | XI |
| Description de la sécurité | S24/25 : Éviter le contact avec la peau et les yeux. S37/39 : Porter des gants appropriés et une protection des yeux/du visage. |
| Identifiants ONU | ONU 2222 |
| Code SH | 29093000 |
| Classe de danger | 3 |
| Groupe d’emballage | III |
| Toxicité | Peut provoquer une irritation des yeux, de la peau et du système respiratoire. Une exposition à long terme peut provoquer des lésions hépatiques et rénales. |
Méthodes de synthèse du méthoxybenzène
L’anisole peut être synthétisé par plusieurs méthodes, notamment la méthylation du phénol avec du sulfate de diméthyle ou du chlorure de méthyle en présence d’une base forte, telle que l’hydroxyde de sodium. Une autre méthode consiste à faire réagir l’anisaldéhyde avec un agent réducteur, tel que le borohydrure de sodium, pour obtenir l’anisole.
Une réaction de Gattermann modifiée peut également être utilisée pour synthétiser l’anisole, qui consiste à faire réagir l’anisole avec du cyanure d’hydrogène et du chlorure d’hydrogène en présence de poudre de cuivre. Cette méthode est utile pour produire de l’anisole en plus grande quantité.
De plus, l’anisole peut être produit par la synthèse de l’éther Williamson en faisant réagir du méthylate de sodium avec du bromobenzène. Cette réaction entraîne la formation d’anisole et de bromure de sodium comme sous-produit.
D’autres méthodes de synthèse de l’anisole comprennent l’utilisation de diazométhane, la méthanolyse de l’acétate de phényle et l’alkylation du phénoxyde de sodium avec de l’iodure de méthyle.
Le choix de la méthode de synthèse dépend de la pureté souhaitée, du rendement et de la quantité d’anisole nécessaire pour une application particulière. Des précautions doivent être prises lors de la synthèse pour garantir que les précautions de sécurité appropriées sont suivies et un équipement de protection approprié est utilisé pour éviter tout contact avec l’anisole.
Utilisations du méthoxybenzène
L’anisole, également connu sous le nom d’anisole, a un large éventail d’utilisations dans diverses industries. L’une de ses principales applications est celle de solvant, notamment dans la production de résines, de vernis et de laques. Il est également utilisé dans la fabrication de divers produits pharmaceutiques, notamment l’aspirine, comme agent aromatisant, ainsi que dans la production de parfums et de fragrances.
L’anisole est également utilisé comme intermédiaire dans la production d’autres produits chimiques, tels que la p-anisidine, un composant clé dans la production de colorants azoïques. Il est également utilisé comme matière première pour la synthèse d’autres dérivés de l’anisole, notamment le p-méthoxyphénol et l’acide p-méthoxycinnamique, qui ont un large éventail d’applications dans l’industrie chimique.
En laboratoire, l’Anisole est utilisé comme étalon en chromatographie en phase gazeuse et en spectrométrie de masse. Il est également utilisé comme matériau de référence pour la spectroscopie.
De plus, l’anisole est utilisé dans la production de divers arômes et parfums, notamment la vanilline, qui est utilisée comme agent aromatisant dans les aliments et les boissons. Dans l’ensemble, la nature polyvalente de l’anisole en fait un produit chimique précieux dans diverses applications, en particulier dans les industries chimique, pharmaceutique et des parfums.
