Le nitrate de plomb (Pb(NO₃)₂) est un solide cristallin blanc. Il est soluble dans l’eau et couramment utilisé en laboratoire pour diverses applications, comme la fabrication d’autres composés de plomb et de feux d’artifice.
| Nom UICPA | Nitrate de plomb(II) |
| Formule moléculaire | Pb(NO₃)₂ |
| Numero CAS | 10099-74-8 |
| Synonymes | Nitrate plombeux, dinitrate de plomb, nitrate de plomb (II), nitrate de plomb (IV) |
| InChI | InChI=1S/2NO3.Pb/c2 2-1(3)4;/q2 -1;+2 |
Propriétés du nitrate de plomb
Formule de nitrate de plomb
La formule chimique du dinitrate de plomb est Pb(NO₃)₂. Cela indique que chaque molécule de dinitrate de plomb contient un atome de plomb (Pb) lié à deux ions NO₃. Cette formule est essentielle pour comprendre la composition et les propriétés du composé.
Nitrate De Plomb Masse molaire
La masse molaire du dinitrate de plomb peut être calculée en additionnant les masses atomiques de ses éléments constitutifs. Pour le plomb (Pb), la masse atomique est d’environ 207,2 g/mol, et pour le NO₃, elle est d’environ 62,0 g/mol. La somme de ces valeurs donne une masse molaire d’environ 331,2 g/mol pour le dinitrate de plomb.
Point d’ébullition du nitrate de plomb
Le point d’ébullition du dinitrate de plomb est la température à laquelle il passe d’un liquide à un gaz sous pression atmosphérique standard. Le point d’ébullition du dinitrate de plomb est relativement élevé, autour de 470°C (878°F), ce qui le rend adapté à certaines applications industrielles.
Point de fusion du nitrate de plomb
Le point de fusion du dinitrate de plomb est la température à laquelle il passe d’un solide à un liquide. Le dinitrate de plomb a un point de fusion d’environ 470°C (878°F). Cette caractéristique permet de déterminer ses conditions appropriées de stockage et de manipulation.
Densité du nitrate de plomb g/mL
La densité du dinitrate de plomb est une mesure de sa masse par unité de volume. La densité du dinitrate de plomb est d’environ 4,53 g/mL. Cette densité élevée en fait une substance lourde et est prise en compte dans divers processus industriels et de laboratoire.
Nitrate De Plomb Poids moléculaire
Le poids moléculaire du dinitrate de plomb, également appelé masse molaire, est d’environ 331,2 g/mol. Cette valeur est cruciale dans les calculs stœchiométriques et pour déterminer la quantité de substance dans un échantillon donné.
Structure du nitrate de plomb
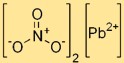
Le dinitrate de plomb a une structure cristalline sous sa forme solide. Les cations Pb²⁺ sont entourés d’anions NO₃⁻ dans un arrangement tridimensionnel. Cette structure de réseau cristallin confère au dinitrate de plomb sa stabilité et ses propriétés caractéristiques.
Solubilité du nitrate de plomb
Le dinitrate de plomb est très soluble dans l’eau. Il se dissout facilement dans l’eau pour former une solution claire et incolore. La solubilité du dinitrate de plomb est essentielle dans diverses applications, comme dans les réactions chimiques et comme précurseur dans la synthèse d’autres composés du plomb. Une manipulation et une élimination appropriées sont cruciales en raison de sa solubilité et de ses impacts environnementaux potentiels.
| Apparence | Solide cristallin blanc |
| Gravité spécifique | 4,53 g/ml |
| Couleur | Incolore |
| Odeur | Inodore |
| Masse molaire | 331,2 g/mole |
| Densité | 4,53 g/ml |
| Point de fusion | 470°C (878°F) |
| Point d’ébullition | ~470°C (~878°F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Très soluble |
| Solubilité | Soluble dans l’eau, légèrement soluble dans l’alcool éthylique |
| Pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | Pas disponible |
| pH | Neutre (autour de 7) |
Sécurité et dangers liés au nitrate de plomb
Le dinitrate de plomb présente plusieurs risques pour la sécurité. Le contact direct avec le composé peut irriter la peau et les yeux. L’inhalation de poussières ou de fumées de dinitrate de plomb peut entraîner des problèmes respiratoires. En raison de sa solubilité dans l’eau, il peut contaminer les sources d’eau et nuire à la vie aquatique. De plus, les composés du plomb sont toxiques lorsqu’ils sont ingérés et une exposition au plomb peut entraîner un empoisonnement au plomb. Pour minimiser les risques, des mesures de sécurité appropriées doivent être prises lors de la manipulation du dinitrate de plomb, comme l’utilisation d’un équipement de protection, le travail dans un endroit bien ventilé et le respect des directives établies pour le stockage, la manipulation et l’élimination. Il est essentiel d’être prudent pour éviter les effets néfastes sur la santé et la contamination de l’environnement.
| Symboles de danger | Danger pour la santé, corrosif, irritant |
| Description de la sécurité | Irritant. Évitez les contacts directs. Utilisez un EPI. |
| Numéros d’identification de l’ONU | No ONU 1469 (Dinitrate de plomb) |
| Code SH | 2834.29.1000 |
| Classe de danger | 5.1 (Agent comburant) |
| Groupe d’emballage | II |
| Toxicité | Toxique en cas d’ingestion ou d’inhalation. |
Méthodes de synthèse du nitrate de plomb
Il existe plusieurs méthodes de synthèse du dinitrate de plomb, toutes impliquant la réaction de composés du plomb avec l’acide nitrique.
Une approche courante consiste à mélanger de l’oxyde de plomb (PbO) ou du carbonate de plomb (PbCO₃) avec de l’acide nitrique concentré (HNO₃). La réaction produit du dinitrate de plomb et de l’eau. Une autre méthode consiste à dissoudre du plomb métallique ou de l’oxyde de plomb dans de l’acide nitrique dilué, conduisant à la formation de dinitrate de plomb.
La deuxième méthode implique la réaction entre Pb(OAc)₂ et le nitrate de sodium . Dans cette approche, dissolvez le Pb(OAc)₂ dans l’eau, puis ajoutez du nitrate de sodium à la solution. La réaction entre ces deux composés conduit à la formation de dinitrate de plomb et d’acétate de sodium.
Le chimiste doit dissoudre le plomb métallique ou l’oxyde de plomb dans de l’acide nitrique dilué et chaud pour synthétiser le dinitrate de plomb en laboratoire. Ils doivent contrôler soigneusement la réaction pour éviter de générer une chaleur et des fumées excessives. Une fois la réaction terminée, la solution de dinitrate de plomb est généralement purifiée par filtration ou cristallisation.
Il est crucial de gérer le processus de synthèse avec précaution en raison de la toxicité des composés du plomb. Pour assurer leur sécurité, ils doivent utiliser une ventilation adéquate et porter un équipement de protection individuelle (EPI) approprié. De plus, ils doivent éliminer tous les déchets de manière appropriée pour éviter la contamination de l’environnement.
Utilisations du nitrate de plomb
Le dinitrate de plomb trouve diverses applications dans différentes industries en raison de ses propriétés uniques. Certaines des principales utilisations du dinitrate de plomb comprennent :
- Produits pyrotechniques : les fabricants utilisent couramment du dinitrate de plomb pour améliorer la luminosité et les couleurs des écrans pyrotechniques, car il agit comme un agent oxydant.
- Industrie des colorants et des pigments : La production de certains pigments et colorants à base de plomb, comme les pigments jaune de chrome et orange, implique l’utilisation de dinitrate de plomb comme matière première.
- Stabilisateur thermique : L’industrie du plastique utilise le dinitrate de plomb comme stabilisant thermique pour le PVC (polychlorure de vinyle) afin d’éviter la dégradation thermique pendant le traitement et l’utilisation.
- Allumettes : les têtes d’allumettes contiennent du dinitrate de plomb pour favoriser l’inflammation lorsqu’elles sont frappées contre une surface rugueuse.
- Galvanoplastie : Les bains de galvanoplastie incorporent du dinitrate de plomb comme composant essentiel pour faciliter le dépôt de revêtements de plomb sur diverses surfaces.
- Chimie analytique : les laboratoires utilisent le dinitrate de plomb comme réactif pour effectuer des tests et des analyses chimiques spécifiques.
- Inhibiteur de corrosion : Certaines formulations utilisent du dinitrate de plomb comme inhibiteur de corrosion pour les métaux, les protégeant de l’oxydation et de la dégradation.
- Produits pharmaceutiques : L’industrie pharmaceutique utilise occasionnellement du dinitrate de plomb comme réactif dans des processus de synthèse spécifiques.
Des questions:
Q : Le nitrate de plomb est-il soluble ?
R : Oui, le dinitrate de plomb est soluble dans l’eau.
Q : De l’argent métallique est ajouté à une solution de nitrate de plomb (ii). Qu’est-ce qu’une réaction chimique équilibrée ?
A : Réaction chimique équilibrée : 2Ag + Pb(NO₃)₂ → 2AgNO₃ + Pb.
Q : Le nitrate de plomb ii est-il un électrolyte ?
R : Oui, le dinitrate de plomb (II) est un électrolyte.
Q : Quel est le % massique de plomb dans le nitrate de plomb (ii) (pb(no3)2) arrondi à trois chiffres significatifs ?
R : Le % massique de plomb dans Pb(NO₃)₂ est d’environ 73,5 %.
Q : Que se passe-t-il lorsque le nitrate de plomb est chauffé ?
R : Lorsque le dinitrate de plomb est chauffé, il se décompose pour produire de l’oxyde de plomb, du dioxyde d’azote et de l’oxygène gazeux.
Q : Le nitrate de plomb est-il soluble dans l’eau ?
R : Oui, le dinitrate de plomb est hautement soluble dans l’eau.
Q : Quels sont les deux gaz libérés lors du chauffage du nitrate de plomb ?
R : Les deux gaz libérés sont le dioxyde d’azote (NO₂) et l’oxygène (O₂).
Q : Qu’observez-vous lorsque le nitrate de plomb est chauffé ?
R : Lorsque le dinitrate de plomb est chauffé, il se décompose, libérant des fumées brunes de dioxyde d’azote et un résidu jaune d’oxyde de plomb reste.
Q : Quel gaz se dégage lorsque le nitrate de plomb est chauffé ?
R : Du dioxyde d’azote gazeux (NO₂) se dégage lorsque le dinitrate de plomb est chauffé.
Q : Que se passera-t-il si nous combinons la solution d’iodure de sodium et la solution de nitrate de plomb (ii) ?
R : Lorsque les solutions d’iodure de sodium et de dinitrate de plomb (II) sont combinées, un précipité jaune d’iodure de plomb (PbI₂) se forme.
