Le zincate de sodium est un composé chimique de formule Na2Zn(OH)4. C’est une poudre solide blanche utilisée comme précurseur dans la synthèse de nanoparticules d’oxyde de zinc et comme réactif en chimie organique.
| Nom UICPA | Zincate de sodium |
| Formule moléculaire | Na2Zn(OH)4 |
| Numero CAS | 12179-14-5 |
| Synonymes | Hydroxyde de zinc et de sodium, zincate de sodium, tétrahydroxyzincate disodique disodique, zinc, tétrahydroxyde |
| InChI | InChI=1S/2Na.O2Zn/c;;1-3-5-6-4-2/q2*+1;-2; |
Formule de zincate de sodium
La formule chimique du zincate de sodium est Na2Zn(OH)4, ce qui indique qu’il contient deux ions sodium (Na+) et un ion oxyde de zinc (ZnO2-). La formule est utilisée pour représenter la composition du composé et peut être utilisée pour calculer la masse molaire, le poids moléculaire et d’autres propriétés du composé. La formule peut également être utilisée pour écrire des équations chimiques et prédire les produits de réactions impliquant le zincate de sodium.
Zincate De Sodium masse molaire:
La masse molaire du zincate de sodium est calculée en additionnant les masses atomiques de tous les éléments présents dans une mole du composé. Pour le zincate de sodium (Na2Zn(OH)4), la masse molaire est d’environ 179,42 g/mol. Cette valeur peut être utile pour déterminer la quantité de zincate de sodium nécessaire pour préparer une quantité spécifique de solution ou pour déterminer la masse du composé dans un échantillon donné.
Point d’ébullition du zincate de sodium :
Na2Zn(OH)4 est un composé solide et n’a pas de point d’ébullition. Cependant, il se décompose à des températures élevées et les gaz qui en résultent peuvent avoir des points d’ébullition en fonction de leur composition. Par conséquent, le point d’ébullition de Na2Zn(OH)4 n’est pas une propriété pertinente.
Densité du Zincate de Sodium g/ml :
La densité de Na2Zn(OH)4 est d’environ 2,7 g/cm³. Cette valeur peut être utile pour déterminer la masse d’un volume spécifique de Na2Zn(OH)4 ou pour déterminer le volume d’une masse spécifique de zincate de sodium. La densité dépend de la température et de la pression et peut varier en fonction des conditions spécifiques de l’expérience.
Poids moléculaire du zincate de sodium :
Le poids moléculaire de Na2Zn(OH)4 est calculé en additionnant les poids atomiques de tous les atomes de la molécule. Le zincate de sodium a un poids moléculaire d’environ 179,42 g/mol. Le poids moléculaire est une propriété importante car il est utilisé dans les calculs liés à la quantité de zincate de sodium requise dans une réaction ou une formulation.
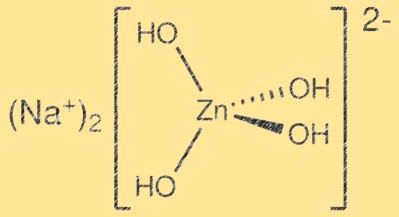
Structure du zincate de sodium :
Na2Zn(OH)4 a une structure cristalline complexe avec des couches de tétraèdres ZnO4 et d’octaèdres Na2O6. Les tétraèdres ZnO4 partagent des coins pour former un réseau tridimensionnel, tandis que les octaèdres Na2O6 occupent les espaces interstitiels. La structure résultante est en couches et peut être décrite comme un dérivé de la structure wurtzite. Les couches sont maintenues ensemble par les forces de Van der Waals et la structure cristalline qui en résulte est relativement faible.
| Apparence | Poudre solide blanche |
| Gravité spécifique | 2,7 g/cm³ |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 179,42 g/mole |
| Densité | 2,7 g/cm³ |
| Point de fusion | N / A |
| Point d’ébullition | N / A |
| Point d’éclair | N / A |
| Solubilité dans l’eau | Soluble |
| Solubilité | Soluble dans l’eau, insoluble dans les solvants organiques |
| Pression de vapeur | N / A |
| Densité de vapeur | N / A |
| pKa | N / A |
| pH | Alcalin (pH > 7) |
Notez que certaines propriétés, telles que le point d’éclair et la pression de vapeur, ne sont pas pertinentes pour le zincate de sodium car il s’agit d’un composé solide.
Sécurité et dangers du zincate de sodium
Na2Zn(OH)4 présente certains risques de sécurité et de danger qui doivent être pris en compte lors de la manipulation du composé. Il est important de porter un équipement de protection individuelle approprié, tel que des gants et des lunettes de sécurité, lors de la manipulation du Na2Zn(OH)4. Le composé peut provoquer une irritation de la peau et des yeux, et son ingestion peut entraîner des troubles gastro-intestinaux. Na2Zn(OH)4 peut également présenter un risque d’incendie et doit être stocké dans un endroit frais et sec, à l’écart de la chaleur et des sources d’inflammation. Une manipulation et un stockage appropriés du Na2Zn(OH)4 peuvent contribuer à minimiser les risques associés au composé.
| Symboles de danger | Aucun |
| Description de la sécurité | S22 : Ne respirez pas la poussière. S24/25 : Éviter le contact avec la peau et les yeux. S37/39 : Porter des gants appropriés et une protection des yeux/du visage. |
| Numéros d’identification de l’ONU | N’est pas applicable |
| Code SH | 2834.29 |
| Classe de danger | Non classé comme dangereux |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | La toxicité exacte du zincate de sodium n’est pas bien caractérisée, mais il peut provoquer une irritation de la peau et des yeux et peut être nocif en cas d’ingestion. Il est important de manipuler le composé avec précaution et de porter un équipement de protection individuelle approprié. |
Méthodes de synthèse du zincate de sodium
Pour synthétiser Na2Zn(OH)4, on peut mettre en œuvre plusieurs méthodes, mais la méthode la plus courante consiste à mélanger de l’oxyde de zinc et de l’hydroxyde de sodium dans une solution aqueuse. Tout d’abord, il faut mélanger l’oxyde de zinc avec l’hydroxyde de sodium dans une solution aqueuse. Ensuite, chauffez et remuez le mélange jusqu’à ce qu’une solution claire se forme. Une fois la solution refroidie, Na2Zn(OH)4 précipitera hors de la solution, qui devra être lavée à l’eau et séchée pour obtenir le produit final.
Une autre façon de synthétiser Na2Zn(OH)4 consiste à ajouter du zinc à une solution d’hydroxyde de sodium et à chauffer le mélange jusqu’à ce qu’une solution claire se forme. Une fois la solution refroidie, Na2Zn(OH)4 précipitera hors de la solution, qui devra être lavée à l’eau et séchée pour obtenir le produit final.
Il est crucial d’effectuer la synthèse de Na2Zn(OH)4 dans un endroit bien ventilé et de porter un équipement de protection individuelle approprié. Il faut également être prudent lors de la manipulation de l’hydroxyde de sodium, car il peut être corrosif et provoquer une irritation de la peau et des yeux.
Utilisations du zincate de sodium
Diverses industries utilisent Na2Zn(OH)4 à des fins multiples. L’une de ses principales applications est de servir de précurseur pour la synthèse de l’oxyde de zinc, que les fabricants utilisent dans la production de caoutchouc, de céramiques et d’autres produits. Na2Zn(OH)4 agit comme stabilisant dans la production de fibres synthétiques et de plastiques.
Dans l’industrie agricole, les agriculteurs utilisent Na2Zn(OH)4 comme engrais pour fournir aux plantes des nutriments essentiels tels que le zinc. Il peut également protéger les cultures contre les maladies fongiques, en servant de fongicide.
Les fabricants de pigments, tels que le jaune de zinc, utilisent Na2Zn(OH)4 dans leur production, qui est couramment utilisé dans les peintures et les revêtements. De plus, les industries utilisent Na2Zn(OH)4 comme inhibiteur de corrosion pour protéger les métaux de la corrosion.
Dans l’industrie pharmaceutique, Na2Zn(OH)4 sert de source de zinc, un nutriment essentiel à la santé humaine. Le zinc est un élément essentiel dans divers processus biologiques, jouant un rôle essentiel dans le maintien d’un système immunitaire sain et favorisant la cicatrisation des plaies.
Dans l’ensemble, Na2Zn(OH)4 a une gamme d’applications importantes dans diverses industries et constitue un composé polyvalent avec de nombreuses utilisations potentielles.
Des questions:
Le zincate de sodium est-il un sel ?
Le zincate de sodium est considéré comme un sel car il forme un composé ionique par la réaction d’un métal (zinc) et d’une base (hydroxyde de sodium). Les forces électrostatiques maintiennent ensemble les ions zinc chargés positivement et les ions sodium et hydroxyde chargés négativement. Les sels sont des composés ioniques formés par la réaction entre un acide et une base ou un métal et un non-métal. Bien que Na2Zn(OH)4 ne résulte pas de la réaction d’un acide et d’une base, il répond néanmoins à la définition générale d’un sel en tant que composé ionique.
