Le butanal ou butyraldéhyde est un composé organique de formule C4H8O. C’est un liquide incolore avec une odeur âcre et est couramment utilisé comme matière première pour la synthèse d’autres produits chimiques.
| Nom UICPA | Butanal |
| Formule moléculaire | C4H8O |
| Numero CAS | 123-72-8 |
| Synonymes | Butyraldéhyde, aldéhyde butyrique, butanaldéhyde, butyral, N-butanal, butaldéhyde, hydrure de butyryle, 1-butanal, 1-butyraldéhyde |
| InChI | InChI=1S/C4H8O/c1-2-3-4-5/h4H,2-3H2,1H3 |
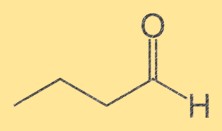
Structure butanale
La structure du Butanal se compose d’une chaîne à quatre carbones avec un groupe aldéhyde terminal (-CHO) attaché. Les atomes de carbone sont numérotés séquentiellement, le groupe aldéhyde étant attaché au premier carbone. La structure du Butanal est importante car elle détermine ses propriétés chimiques et physiques.
Spectre IR butanal
Le spectre infrarouge (IR) du Butanal est utilisé pour identifier les groupes fonctionnels présents dans la molécule. Le spectre IR du Butanal montre des pics caractéristiques pour le groupe carbonyle (-C=O) à environ 1 730 cm-1, et pour les vibrations d’étirement du CH à environ 2 800-3 000 cm-1. Le spectre IR est un outil puissant en chimie organique pour identifier et caractériser les composés.
Masse molaire du butanal
Le butanal a une masse molaire de 72,11 g/mol. La masse molaire d’un composé est la somme des masses atomiques de tous les atomes d’une molécule de ce composé. Dans le cas du Butanal, la masse molaire est calculée en additionnant les masses atomiques de quatre atomes de carbone, huit atomes d’hydrogène et un atome d’oxygène.
Point d’ébullition du butanal
Le point d’ébullition du Butanal est de 75 °C ou 167 °F. Il s’agit de la température à laquelle la pression de vapeur du liquide est égale à la pression atmosphérique et le liquide commence à bouillir. Le butanal a un point d’ébullition relativement bas, ce qui le rend volatil et s’évapore facilement à température ambiante.
Point de fusion du butanal
Le point de fusion du Butanal est de -97 °C ou -143 °F. C’est la température à laquelle une substance solide passe à l’état liquide. Le butanal a un point de fusion très bas, ce qui signifie qu’il est généralement à l’état liquide à température ambiante.
Densité du butyraldéhyde g/ml
La densité du butyraldéhyde est de 0,81 g/mL. La densité est la quantité de masse par unité de volume et elle est généralement exprimée en grammes par millilitre pour les liquides. le butyraldéhyde a une densité inférieure à celle de l’eau, ce qui signifie qu’il flotte à la surface de l’eau.
Poids moléculaire du butyraldéhyde
Le poids moléculaire du butyraldéhyde est de 72,11 g/mol. C’est la même chose que la masse molaire et elle représente la masse d’une molécule de butyraldéhyde. Le poids moléculaire est un paramètre important utilisé dans les calculs et analyses chimiques.
Formule de butyraldéhyde
La formule chimique du butyraldéhyde est C4H8O. Cette formule indique le nombre d’atomes de chaque élément dans une molécule de butyraldéhyde. Il y a quatre atomes de carbone, huit atomes d’hydrogène et un atome d’oxygène dans le butyraldéhyde.
| Apparence | Liquide incolore |
| Gravité spécifique | 0,81 g/ml |
| Couleur | Incolore |
| Odeur | Piquant, âcre |
| Masse molaire | 72,11 g/mole |
| Densité | 0,81 g/ml |
| Point de fusion | -97 °C (-143 °F) |
| Point d’ébullition | 75 °C (167 °F) |
| Point d’éclair | -6,7 °C (20 °F) |
| Solubilité dans l’eau | Miscible |
| Solubilité | Soluble dans l’éthanol, l’éther, l’acétone |
| La pression de vapeur | 44 mmHg à 20 °C |
| Densité de vapeur | 2,5 (air=1) |
| pKa | 16.92 |
| pH | 4,5-6,5 |
Sécurité et dangers du butanal
Le butyraldéhyde est un liquide inflammable et peut présenter un risque d’incendie s’il est exposé à la chaleur ou aux flammes. Il peut également provoquer une irritation des yeux et de la peau au contact, et l’inhalation de vapeurs peut provoquer une irritation des voies respiratoires. Par conséquent, il est important de manipuler le butyraldéhyde avec prudence, en portant un équipement de protection individuelle approprié, tel que des gants et des lunettes. Il doit être stocké dans un endroit frais, sec et bien ventilé, à l’écart des sources de chaleur et d’ignition. En cas d’exposition ou d’ingestion, consulter immédiatement un médecin. Il est également important de suivre les procédures appropriées d’élimination des déchets pour le butyraldéhyde afin de prévenir la contamination de l’environnement.
| Symboles de danger | Flamme, Corrosif, Irritant |
| Description de la sécurité | Tenir à l’écart de la chaleur/des étincelles/des flammes nues/des surfaces chaudes. Porter des gants de protection/un équipement de protection des yeux/du visage. EN CAS DE CONTACT AVEC LA PEAU (ou les cheveux) : Enlever immédiatement tous les vêtements contaminés. Rincer la peau à l’eau/douche. En cas d’incendie : Utiliser de la poudre chimique sèche pour éteindre. |
| Numéros d’identification de l’ONU | UN1125 |
| Code SH | 2912.19.00 |
| Classe de danger | 3 |
| Groupe d’emballage | II |
| Toxicité | Le butanal est nocif s’il est ingéré, inhalé ou absorbé par la peau. Il peut provoquer une irritation des yeux et de la peau, et une exposition prolongée peut entraîner des lésions hépatiques et rénales. Il s’est également révélé mutagène et cancérigène dans des études animales. Une manipulation et une élimination appropriées sont importantes pour prévenir l’exposition et la contamination. |
Méthodes de synthèse du butanal
Le butyraldéhyde peut être synthétisé par diverses méthodes, notamment l’oxydation des alcools primaires, l’ozonolyse des alcènes et l’hydroformylation des alcènes.
Une méthode courante de synthèse du butyraldéhyde est l’oxydation d’alcools primaires à l’aide d’un agent oxydant tel que le permanganate de potassium ou l’acide chromique. L’alcool primaire est d’abord converti en aldéhyde correspondant à l’aide d’un agent réducteur doux tel que le chlorochromate de pyridinium, puis oxydé en butyraldéhyde. Une autre méthode implique l’ozonolyse des alcènes pour produire des aldéhydes, qui peuvent ensuite être réduits en butyraldéhyde à l’aide d’un agent réducteur tel que le borohydrure de sodium.
L’hydroformylation des alcènes est également une méthode couramment utilisée pour synthétiser le butyraldéhyde. Cela implique une réaction de l’alcène avec le monoxyde de carbone et l’hydrogène gazeux en présence d’un catalyseur tel que le cobalt carbonyle ou le complexe de rhodium. L’aldéhyde résultant peut ensuite être réduit en butyraldéhyde à l’aide d’un agent réducteur tel que l’hydrure de lithium et d’aluminium.
D’autres méthodes de synthèse du butyraldéhyde comprennent la réaction des réactifs de Grignard avec le formaldéhyde et la réaction des cétones avec l’acide formique et l’hydrogène gazeux en présence d’un catalyseur.
Dans l’ensemble, le choix de la méthode de synthèse dépend de facteurs tels que la disponibilité des matières premières, le rendement et la pureté souhaités, ainsi que la faisabilité des conditions de réaction.
Utilisations du butanal
Le butanal a diverses utilisations industrielles et commerciales en raison de sa réactivité et de son odeur distincte.
Une utilisation majeure du Butanal est comme matière première pour la production d’autres produits chimiques, tels que l’acrylate de butyle et le n-butanol. Ces produits chimiques sont utilisés dans la fabrication de revêtements, d’adhésifs et de plastiques.
Le butanal est également utilisé comme agent aromatisant dans l’industrie alimentaire, apportant un arôme fruité semblable à celui de la pomme à divers produits tels que les produits de boulangerie, les bonbons et les boissons. Il est également utilisé comme parfum dans les parfums et les savons.
De plus, le Butanal est utilisé comme solvant en synthèse organique et comme réactif dans les réactions de chimie organique. Il peut être utilisé pour convertir les aldéhydes en alcools secondaires et pour produire des esters en réagissant avec des acides carboxyliques.
Le butanal a également été utilisé dans des études de recherche comme outil pour comprendre les mécanismes d’activation des récepteurs olfactifs dans le cerveau, en raison de sa forte odeur.
Cependant, il est important de noter que le Butanal peut présenter des risques pour la sécurité s’il n’est pas manipulé correctement, et des précautions appropriées doivent être prises lors de son utilisation et de son stockage. Dans l’ensemble, la polyvalence et les propriétés uniques du Butanal en font un produit chimique important dans diverses industries et domaines de recherche.
Des questions:
Quelle est l’enthalpie standard de formation du butyraldéhyde liquide, ch3ch2ch2cho(l) ?
L’enthalpie standard de formation (∆H°f) du butyraldéhyde liquide (CH3CH2CH2CHO(l)) à 25°C est de -146,6 kJ/mol.
Cela signifie que le changement d’enthalpie associé à la formation de 1 mole de butyraldéhyde liquide à partir de ses éléments constitutifs dans leurs états standards (dans ce cas, le carbone, l’hydrogène et l’oxygène sous leurs formes élémentaires) est de -146,6 kJ/mol à 25°C. et 1 atm de pression.
Le signe négatif indique que la réaction est exothermique, c’est à dire qu’elle dégage de la chaleur. Cette valeur est utile pour calculer le changement d’enthalpie des réactions impliquant le butyraldéhyde comme réactif ou produit.
