Le tétrafluoroéthylène ou C2F4 est un gaz incolore et inodore utilisé dans la production de polymères fluorés comme le téflon. Il est également utilisé dans la production de réfrigérants et de propulseurs.
| Nom de l’UICPA | Tétrafluoroéthylène |
| Formule moléculaire | C2F4 |
| Numero CAS | 116-14-3 |
| Synonymes | TFE, perfluoroéthylène, éthène, tétrafluoro-, F4E, fréon 1113, halocarbure 1113 |
| InChI | InChI=1S/C2F4/c3-1(4)2(5)6 |
Structure de Lewis C2F4
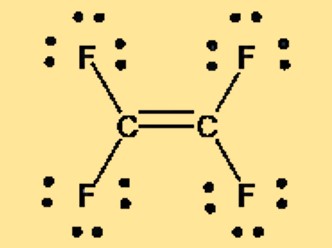
La structure de Lewis du tétrafluoroéthylène, également connue sous le nom de TFE ou C2F4, peut être représentée par deux atomes de carbone doublement liés l’un à l’autre, chaque atome de carbone étant lié à deux atomes de fluor. La structure de Lewis montre la disposition des électrons de valence dans la molécule et fournit des informations sur la liaison et la géométrie de la molécule. La nature non polaire du TFE est également évidente dans sa structure de Lewis, qui ne présente aucune séparation de charge ni de moment dipolaire net.
Masse molaire du tétrafluoroéthylène
La masse molaire du tétrafluoroéthylène, également appelé TFE ou C2F4, est de 100,02 g/mol. Cette valeur est calculée en additionnant les masses atomiques de tous les éléments présents dans la molécule, qui sont deux atomes de carbone et quatre atomes de fluor. La masse molaire est un paramètre important pour déterminer la quantité d’une substance présente dans un volume ou une masse donnée et est également utilisée dans les calculs stoechiométriques.
Point d’ébullition du tétrafluoroéthylène
Le tétrafluoroéthylène a un point d’ébullition de -76,3 °C (-105,34 °F) à pression standard. C’est un gaz très volatil qui peut se vaporiser rapidement à température ambiante et à pression atmosphérique. Le faible point d’ébullition du TFE le rend idéal pour diverses applications industrielles telles que dans les systèmes de réfrigération et comme propulseur pour les aérosols.
Point de fusion du tétrafluoroéthylène
Le tétrafluoroéthylène n’a pas de point de fusion distinct car il subit une transition de phase directement du solide au gaz, en sautant la phase liquide. Cependant, la forme solide du TFE peut exister à des températures inférieures à -76,3 °C dans des conditions de haute pression. La forme solide du TFE est également très instable et réactive et peut se polymériser ou se décomposer spontanément.
Densité du tétrafluoroéthylène g/ml
La densité du tétrafluoroéthylène à température et pression standard (STP) est de 1,47 g/L. Cependant, le TFE étant un gaz, sa densité peut varier considérablement en fonction des changements de température et de pression. À température ambiante et pression atmosphérique, la densité du TFE est d’environ 3,21 g/L.
Poids moléculaire du tétrafluoroéthylène
Le poids moléculaire du C2F4 est de 100,02 g/mol. Cette valeur est calculée en additionnant les poids atomiques de tous les atomes présents dans la molécule. Le TFE a un poids moléculaire relativement faible, ce qui contribue à sa forte volatilité et à son faible point d’ébullition.
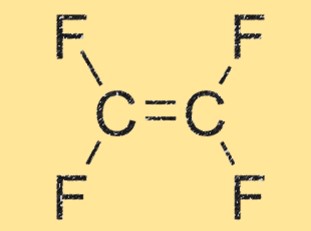
Structure C2F4
C2F4 a une structure linéaire, avec deux atomes de carbone doublement liés l’un à l’autre et chacun lié à deux atomes de fluor. La molécule est hautement symétrique et n’a pas de moment dipolaire net, ce qui la rend non polaire. La géométrie linéaire du TFE contribue également à sa haute réactivité et à sa capacité à former des chaînes polymères.
Formule C2F4
La formule chimique du C2F4 est C2F4, ce qui indique que la molécule contient deux atomes de carbone et quatre atomes de fluor. La formule fournit des informations sur les types et le nombre d’atomes présents dans la molécule, ce qui peut être utile pour prédire son comportement chimique et ses réactions.
| Apparence | Gaz incolore |
| Gravité spécifique | 1,47 g/L à STP |
| Couleur | Incolore |
| Odeur | Inodore |
| Masse molaire | 100,02 g/mole |
| Densité | 3,21 g/L à température ambiante et pression atmosphérique |
| Point de fusion | N’a pas de point de fusion distinct |
| Point d’ébullition | -76,3 °C (-105,34 °F) à pression standard |
| Point d’éclair | Non applicable car le TFE est un gaz |
| Solubilité dans l’eau | Insoluble |
| Solubilité | Soluble dans certains solvants organiques tels que l’acétone et le chloroforme |
| La pression de vapeur | 209,7 kPa à 20 °C |
| Densité de vapeur | 2,95 (air = 1) |
| pKa | Non applicable, car le TFE n’est ni un acide ni une base |
| pH | Non applicable, car le TFE n’est ni un acide ni une base |
Sécurité et dangers du tétrafluoroéthylène
Le tétrafluoroéthylène peut présenter plusieurs risques pour la sécurité et la santé s’il n’est pas manipulé correctement. L’exposition à des concentrations élevées de TFE peut provoquer une irritation des yeux, de la peau et des voies respiratoires. Une exposition prolongée peut également entraîner des lésions pulmonaires, notamment un œdème pulmonaire et une pneumonie. Le TFE est également un gaz inflammable qui peut former des mélanges explosifs avec l’air. Par conséquent, il doit être stocké et transporté dans des conteneurs spécialisés pour éviter les risques d’incendie ou d’explosion. Il est important d’utiliser un équipement de protection approprié, y compris une protection respiratoire, lors de la manipulation du TFE afin de prévenir l’exposition et de minimiser le risque d’effets néfastes sur la santé.
| Symboles de danger | F+ (hautement inflammable) |
| Description de la sécurité | Gaz hautement inflammable. Provoque une grave irritation des yeux. Peut provoquer une irritation respiratoire. |
| Numéros d’identification de l’ONU | UN1080 |
| Code SH | 2903.39 |
| Classe de danger | 2.1 (Gaz inflammable) |
| Groupe d’emballage | Non applicable car le TFE est un gaz |
| Toxicité | Le TFE a une faible toxicité aiguë, mais une exposition prolongée peut entraîner des lésions pulmonaires et d’autres effets néfastes sur la santé. Le TFE est également considéré comme un cancérogène potentiel pour l’homme. |
Méthodes de synthèse du tétrafluoroéthylène
Le tétrafluoroéthylène (TFE) peut être synthétisé par plusieurs méthodes, notamment la décomposition thermique et catalytique de divers composés fluorocarbonés.
Une méthode courante de synthèse du TFE est la décomposition thermique du chlorodifluorométhane (CCl2F2) en présence d’un initiateur approprié à haute température. Le processus consiste à rompre les liaisons carbone-chlore dans CCl2F2 pour former un radical, qui réagit ensuite avec d’autres molécules pour produire du TFE.
Une autre méthode est la décomposition catalytique de composés fluorocarbonés tels que l’hexafluoropropène (HFP) ou l’octafluorocyclobutane (OFCB) sur un catalyseur approprié, tel que le chlorure d’aluminium ou le pentafluorure d’antimoine, à haute température. Cette méthode produit un mélange de TFE et d’autres sous-produits fluorocarbonés, qui sont ensuite séparés et purifiés.
De plus, le TFE peut être synthétisé par fluoration électrochimique, un processus qui consiste à faire passer un mélange d’hydrogène et de fluor gazeux sur une anode métallique en présence d’un électrolyte. Cette méthode produit un mélange de TFE et d’autres composés fluorés, qui sont ensuite séparés et purifiés.
Dans l’ensemble, la synthèse du TFE nécessite un équipement et une expertise spécialisés en raison de la nature hautement réactive et dangereuse des produits chimiques impliqués. Par conséquent, il est important de suivre les protocoles et réglementations de sécurité appropriés lors de la synthèse du TFE.
Utilisations du tétrafluoroéthylène
Le tétrafluoroéthylène (TFE) est un produit chimique polyvalent avec plusieurs applications industrielles et commerciales.
- L’une des principales utilisations du TFE est comme monomère pour la production de polytétrafluoroéthylène (PTFE), un polymère antiadhésif et résistant à la chaleur communément appelé téflon.
- Le TFE sert de matière première pour produire d’autres composés fluorés, tels que les acides carboxyliques perfluorés et les sulfonates de perfluoroalkyle, qui ont des applications dans l’électronique, le textile et d’autres industries.
- Le TFE joue un rôle crucial dans la production de polymères fluorés, tels que le fluorure de polyvinylidène (PVDF), qui sont largement utilisés dans les revêtements, les tuyaux et les fils en raison de leur haute résistance chimique et de leur durabilité.
- Les fabricants utilisent le TFE comme réfrigérant dans les systèmes de climatisation et de réfrigération et dans la production de matériaux isolants en mousse.
- L’industrie pharmaceutique utilise le TFE comme solvant et propulseur pour les formulations d’aérosols.
- Le TFE trouve de nombreuses applications, notamment les revêtements pour ustensiles de cuisine, l’isolation électrique et les joints hautes performances.
Dans l’ensemble, la polyvalence et les propriétés uniques du TFE en font un produit chimique précieux dans un large éventail d’applications industrielles et commerciales. Cependant, il est important de suivre les protocoles et réglementations de sécurité appropriés lors de la manipulation du TFE afin de minimiser le risque d’effets néfastes sur la santé et de dommages environnementaux.
Des questions:
Quelles orbitales atomiques ou hybrides constituent la liaison sigma entre c2 et f dans le tétrafluoroéthylène, c2f4 ?
La liaison sigma entre C2 et F dans le tétrafluoroéthylène (C2F4) est formée par le chevauchement d’orbitales hybrides. Dans C2F4, chaque atome de carbone est hybridé sp2, ce qui signifie que ses trois orbitales atomiques (une orbitale 2s et deux orbitales 2p) se combinent pour former trois orbitales hybrides sp2, disposées selon une géométrie planaire trigonale. Chaque atome de carbone possède également une orbitale 2p non hybridée, perpendiculaire au plan des orbitales sp2.
L’atome de fluor a une orbitale 2p occupée une seule fois qui chevauche l’orbitale 2p non hybridée de l’atome de carbone adjacent pour former la liaison sigma. Ce chevauchement se produit bout à bout entre les deux atomes, ce qui entraîne une disposition linéaire des atomes dans la molécule. Les électrons de la liaison sigma sont principalement situés dans la région située entre les deux noyaux, créant une forte liaison covalente entre les atomes de carbone et de fluor.
Le téflon est produit à partir du tétrafluoroéthylène polymérisé ?
Oui, le téflon est produit par polymérisation du tétrafluoroéthylène (TFE). Le TFE est un gaz incolore et inodore qui peut être polymérisé en présence d’un catalyseur pour former du polytétrafluoroéthylène (PTFE), communément appelé Téflon.
Le processus de polymérisation consiste à initier la réaction à l’aide d’un initiateur radicalaire tel que le persulfate d’ammonium ou l’azobisisobutyronitrile (AIBN), qui génère des radicaux libres qui initient la réaction en chaîne des monomères TFE polymérisés en PTFE.
