L’éthylène, également connu sous le nom d’éthylène, est un gaz incolore et inflammable avec une odeur sucrée. Il s’agit d’un élément essentiel de l’industrie chimique, utilisé dans la production de plastiques, de solvants et d’autres produits chimiques.
| Nom de l’UICPA | Éthène |
| Formule moléculaire | C2H4 |
| Numero CAS | 74-85-1 |
| Synonymes | Éthylène, Éthène (par erreur), Gaz oléfiant, Elayl, 1,2-Dihydrogène éthylène |
| InChI | InChI=1S/C2H4/c1-2/h1-2H2 |
Formule d’éthylène
La formule chimique de l’éthène est C2H4. Il représente le nombre et le type d’atomes présents dans une molécule d’éthène. La formule est utilisée dans les réactions chimiques et les calculs impliquant l’éthylène, tels que la détermination de la stœchiométrie d’une réaction ou de la quantité d’éthylène requise pour un processus industriel particulier.
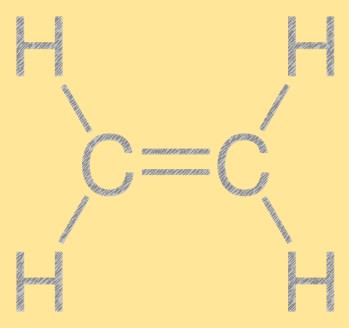
Structure en éthylène
L’éthylène a une structure linéaire simple, avec deux atomes de carbone liés par une double liaison et quatre atomes d’hydrogène attachés à chaque atome de carbone. La double liaison carbone-carbone est responsable de la réactivité de l’éthylène, ce qui en fait un élément de base utile dans l’industrie chimique. La molécule a une structure planaire, tous les atomes se trouvant dans le même plan.
Éthène Masse molaire
La masse molaire de l’éthène, également appelé éthylène, est de 28,05 g/mol. C’est une molécule organique simple composée de deux atomes de carbone et de quatre atomes d’hydrogène, représentée par la formule chimique C2H4. La masse molaire est calculée en additionnant les masses atomiques des atomes individuels de la molécule.
La masse molaire est un paramètre important dans les réactions chimiques et les calculs impliquant l’éthylène. Il est utilisé pour déterminer la quantité d’éthylène nécessaire dans une réaction, ainsi que la quantité de produits pouvant être produits.
Point d’ébullition de l’éthylène
Le point d’ébullition de l’éthène est de -103,7°C (-154,7°F). L’éthylène est un gaz à température et pression ambiantes, et son point d’ébullition est bien inférieur à celui de l’eau, ce qui facilite sa séparation des autres substances dans les processus industriels.
Le point d’ébullition de l’éthène dépend de la pression et de la pureté de l’échantillon. À des pressions plus élevées, le point d’ébullition de l’éthène augmente. De même, les impuretés présentes dans l’échantillon peuvent faire varier le point d’ébullition par rapport à la valeur attendue.
Éthène Point de fusion
Le point de fusion de l’éthylène est de -169,2°C (-272,6°F). L’éthylène est une molécule non polaire de forme linéaire, ce qui en fait une molécule relativement simple par rapport à de nombreux autres composés organiques. Cela se reflète dans son faible point de fusion.
Tout comme le point d’ébullition, le point de fusion de l’éthylène peut varier en fonction de la pureté de l’échantillon. Les impuretés peuvent abaisser le point de fusion et rendre difficile l’obtention d’un échantillon pur à des fins expérimentales.
Densité d’éthylène g/ml
La densité de l’éthylène est de 0,958 g/mL dans des conditions standard de température et de pression (STP), définies comme 0°C (32°F) et 1 atm de pression. L’éthylène est moins dense que l’air, ce qui signifie qu’il peut s’élever et se disperser dans l’atmosphère.
La densité est une propriété physique importante de l’éthylène, car elle est utilisée dans les processus industriels pour déterminer la quantité d’éthylène nécessaire pour un volume d’espace donné. Il est également utilisé pour calculer la masse d’éthylène dans un échantillon.
Poids moléculaire de l’éthylène
Le poids moléculaire de l’éthylène est de 28,05 g/mol. C’est la somme des poids atomiques des atomes constitutifs de la molécule. Le poids moléculaire est un paramètre important dans de nombreux calculs chimiques, notamment pour déterminer la stœchiométrie d’une réaction et la quantité de réactifs et de produits requis ou produits.
| Apparence | Gaz incolore |
| Densité spécifique | 0,968 g/mL à 20°C (68°F) |
| Couleur | Incolore |
| Odeur | Doux, piquant |
| Masse molaire | 28,05 g/mole |
| Densité | 0,958 g/mL à 0°C et 1 atm |
| Point de fusion | -169,2°C (-272,6°F) |
| Point d’ébullition | -103,7°C (-154,7°F) à une pression de 1 atm |
| Point d’éclair | -136°C (-213°F) |
| Solubilité dans l’eau | 3,5 g/L à 25°C (77°F) |
| Solubilité | Insoluble dans l’eau, soluble dans les solvants organiques |
| Pression de vapeur | 114,6 kPa à 20°C (68°F) |
| Densité de vapeur | 0,97 (air = 1) |
| pKa | 44 |
| pH | Sans objet, puisque l’éthylène n’est pas une solution aqueuse |
Sécurité et dangers liés à l’éthylène
L’éthylène est un gaz hautement inflammable qui peut former des mélanges explosifs avec l’air. Il peut s’enflammer spontanément dans l’air si la concentration est suffisamment élevée. L’éthylène est également un asphyxiant et peut déplacer l’oxygène dans les espaces confinés, posant ainsi un risque d’étouffement.
Le contact avec l’éthylène liquide ou l’exposition à des concentrations élevées de gaz peut provoquer des engelures ou des brûlures. L’éthylène n’est pas toxique, mais ses produits de combustion, notamment le monoxyde de carbone et le dioxyde de carbone, peuvent être dangereux pour la santé humaine.
La manipulation de l’éthylène nécessite des mesures de sécurité appropriées, notamment une ventilation adéquate, un équipement de protection individuelle et des précautions de sécurité incendie. L’éthylène doit être stocké et transporté dans des zones bien ventilées, loin des sources d’inflammation.
| Symboles de danger | Gaz inflammable (GHS02), asphyxiant simple (GHS09) |
| Description de la sécurité | Tenir à l’écart des sources d’ignition – Ne pas fumer. Utilisez uniquement des outils anti-étincelles. Ne respirez pas les gaz. Utiliser uniquement à l’extérieur ou dans un endroit bien ventilé. Porter des gants de protection/des vêtements de protection/un équipement de protection des yeux/du visage. |
| Numéros d’identification de l’ONU | UN 1962 (gaz comprimé) |
| Code SH | 2901.21.00 |
| Classe de danger | 2.1 (gaz inflammable) |
| Groupe d’emballage | N / A |
| Toxicité | Non toxique |
Méthodes de synthèse de l’éthylène
Diverses méthodes permettent de synthétiser l’éthylène, notamment le craquage thermique des hydrocarbures et la déshydratation des alcools.
Dans le craquage thermique, le processus consiste à chauffer des hydrocarbures tels que le méthane, le propane et le naphta à des températures élevées (500 à 900 °C) en présence d’un catalyseur pour décomposer les molécules à longue chaîne en molécules plus petites, produisant ainsi de l’éthylène. les produits.
Une autre méthode courante est la déshydratation des alcools, qui implique l’utilisation d’un catalyseur tel que l’alumine ou la silice à haute température (250-350°C) pour déshydrater l’éthanol ou d’autres alcools et former de l’éthylène et de l’eau.
Le vapocraquage est un autre procédé utilisé pour produire de l’éthylène, dans lequel de la vapeur est ajoutée aux hydrocarbures à haute température (700-900°C) pour générer un mélange d’éthylène et d’autres produits.
La décomposition thermique de matières organiques telles que le bois, le papier et les plastiques peut également générer de l’éthylène.
D’autres méthodes de synthèse de l’éthylène comprennent la déshydrogénation oxydative de l’éthane et le procédé de transformation du méthanol en oléfines.
Utilisations de l’éthylène
L’éthylène est un produit chimique industriel important avec un large éventail d’utilisations.
- L’éthylène joue un rôle crucial dans la production de polyéthylène, l’un des plastiques les plus utilisés au monde. Les gens utilisent le polyéthylène dans diverses applications telles que les emballages, les tuyaux et les matériaux de construction.
- Les fabricants utilisent l’éthylène comme ingrédient clé dans la production d’autres polymères, tels que le chlorure de polyvinyle (PVC). Le PVC est utile dans les matériaux de construction, les dispositifs médicaux et les câbles électriques.
- L’éthylène est également crucial dans la fabrication de l’oxyde d’éthylène, une matière première essentielle dans la fabrication de détergents, de solvants et de plastiques.
- Les fabricants utilisent l’éthylène pour produire de l’éthylène glycol, un liquide de refroidissement et de l’antigel pour les moteurs. C’est également une matière première dans la fabrication de fibres, de films et de résines de polyester.
- L’éthylène sert de combustible pour le soudage et la coupe des métaux. Il agit également comme agent de maturation des fruits et légumes.
- L’éthylène est utile dans la synthèse de divers composés organiques, notamment l’éthanol et l’acétaldéhyde.
Dans l’ensemble, la polyvalence de l’éthylène en fait un composant essentiel dans un large éventail de processus industriels, contribuant à de nombreux aspects de la vie moderne.
Des questions:
Quels diènes réagiront avec l’éthylène dans une réaction de Diels-Alder ?
Tout diène contenant deux doubles liaisons conjuguées peut subir une réaction de Diels-Alder avec l’éthène. Des exemples de tels diènes comprennent le 1,3-butadiène et l’isoprène.
Comment les atomes d’hydrogène sont-ils disposés dans l’éthène ?
Dans l’éthène, les deux atomes de carbone sont liés l’un à l’autre par une double liaison. Chaque atome de carbone est également lié à deux atomes d’hydrogène, les valences restantes étant occupées par deux paires d’électrons non partagées sur chaque atome de carbone. La disposition des atomes autour de chaque carbone est plan trigonale.
Combien de liaisons pi se forment lorsque l’hybridation sp2 se produit dans l’éthène, C2H4 ?
Lorsque l’hybridation sp2 se produit dans l’éthène, une liaison pi est formée entre les deux atomes de carbone. Les orbitales hybrides sp2 participent à la formation de liaisons sigma entre les atomes de carbone et les atomes d’hydrogène, tandis que les orbitales p de chaque atome de carbone se chevauchent pour former la liaison pi. L’éthylène est classé parmi les hydrocarbures insaturés car il possède une double liaison entre ses deux atomes de carbone. Cette double liaison est constituée d’une liaison sigma et d’une liaison pi, ce qui signifie que l’éthène possède moins d’atomes d’hydrogène qu’un hydrocarbure saturé comparable possédant le même nombre d’atomes de carbone.
