L’heptoxyde de chlore ou Cl2O7 est un composé hautement explosif et réactif. Il peut se décomposer violemment au contact de la matière organique et constitue un puissant agent oxydant utilisé en synthèse et en analyse chimiques.
| Nom UICPA | Heptoxyde de chlore |
| Formule moléculaire | Cl2O7 |
| Numero CAS | 12015-53-1 |
| Synonymes | Anhydride perchlorique, heptoxyde de dichlore, oxyde de chlore (VII), oxyde de chlore, perchlorate de perchloryle |
| InChI | InChI=1S/Cl2O7/c2-1(3,4,5,6)10-7(8,9)11-12-13-14-10 |
Heptoxyde De Chlore masse molaire
L’heptoxyde de chlore, de formule chimique Cl2O7, a une masse molaire de 182,9 g/mol. Ce composé est composé de deux atomes de chlore et de sept atomes d’oxygène, ce qui en fait un agent hautement oxydant. La masse molaire de l’heptoxyde de chlore est utilisée pour calculer la quantité de substance dans une masse ou un volume donné d’un échantillon à l’aide de la constante d’Avogadro.
Point d’ébullition de l’heptoxyde de chlore
L’heptoxyde de chlore est un solide incolore à jaunâtre, hautement réactif et volatil. Le point d’ébullition de l’heptoxyde de chlore n’est pas bien défini puisqu’il se décompose avant d’atteindre son point d’ébullition. L’heptoxyde de chlore est un puissant agent oxydant qui peut réagir avec la matière organique, l’eau et d’autres substances pour former des composés explosifs.
Point de fusion de l’heptoxyde de chlore
L’heptoxyde de chlore a un point de fusion de -96 °C (-141 °F), ce qui en fait un solide à faible point de fusion. L’heptoxyde de chlore peut exister sous forme de liquide jaunâtre à température ambiante en raison de son faible point de fusion et de sa réactivité élevée. Il est important de manipuler l’heptoxyde de chlore avec précaution car il peut provoquer de graves brûlures et constitue un puissant agent oxydant.
Densité de l’heptoxyde de chlore g/ml
La densité de l’heptoxyde de chlore est de 2,48 g/mL à température ambiante. La haute densité de l’heptoxyde de chlore en fait un liquide dense qui peut rapidement couler au fond d’un récipient. La haute densité et la réactivité de l’heptoxyde de chlore en font un composé difficile à manipuler et nécessite des précautions de sécurité particulières lorsqu’il est utilisé dans la synthèse ou l’analyse chimique.
Poids moléculaire de l’heptoxyde de chlore
Le poids moléculaire de l’heptoxyde de chlore, également connu sous le nom de masse moléculaire relative, est de 182,9 g/mol. Le poids moléculaire de l’heptoxyde de chlore est important dans les calculs chimiques impliquant la quantité de substance, la masse et le volume. Le poids moléculaire élevé de l’heptoxyde de chlore en fait un composé dense et volatil qui nécessite une manipulation et un stockage soigneux.
Structure de l’heptoxyde de chlore
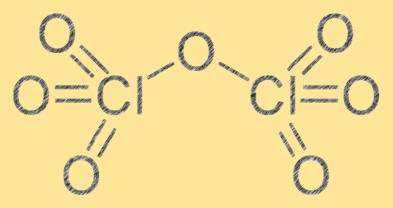
La structure de l’heptoxyde de chlore est composée de deux atomes de chlore et de sept atomes d’oxygène. Il a une formule moléculaire de Cl2O7 et sa géométrie moléculaire est une forme octaédrique déformée en raison de la répulsion entre les atomes d’oxygène. L’heptoxyde de chlore est un puissant agent oxydant et peut réagir avec diverses substances organiques et inorganiques. La structure de l’heptoxyde de chlore est essentielle pour comprendre ses propriétés chimiques et son comportement dans différentes réactions.
Formule heptoxyde de chlore
La formule chimique de l’heptoxyde de chlore est Cl2O7. La formule indique que chaque molécule d’heptoxyde de chlore contient deux atomes de chlore et sept atomes d’oxygène. La formule est utilisée pour calculer la stœchiométrie des réactions chimiques impliquant l’heptoxyde de chlore. La formule de l’heptoxyde de chlore est également importante pour déterminer son poids moléculaire, sa densité et d’autres propriétés physiques et chimiques.
| Apparence | Solide incolore à jaunâtre |
| Gravité spécifique | 2,48 à 25°C |
| Couleur | Incolore à jaunâtre |
| Odeur | Piquant, acide |
| Masse molaire | 182,9 g/mole |
| Densité | 2,48 g/mL à 25°C |
| Point de fusion | -96°C (-141°F) |
| Point d’ébullition | Se décompose avant le point d’ébullition |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Réagit violemment avec l’eau |
| Solubilité | Soluble dans les solvants organiques |
| Pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | Pas disponible |
| pH | N’est pas applicable |
Sécurité et dangers de l’heptoxyde de chlore
L’heptoxyde de chlore est un composé hautement réactif et dangereux qui présente des risques importants pour la sécurité s’il n’est pas manipulé correctement. Il peut provoquer de graves brûlures et des lésions aux yeux, à la peau et au système respiratoire au contact. L’heptoxyde de chlore peut également réagir violemment avec l’eau et les matières organiques, entraînant des explosions et des risques d’incendie. Il est essentiel d’utiliser un équipement de protection individuelle approprié, notamment des gants, des lunettes et des respirateurs lors de la manipulation de l’heptoxyde de chlore. Le composé doit être stocké et transporté dans un récipient sécurisé et bien fermé, à l’écart des sources d’ignition, de chaleur ou d’humidité. Des procédures de manipulation appropriées et des précautions de sécurité doivent être suivies pour minimiser les risques associés à l’heptoxyde de chlore.
| Symboles de danger | Agent oxydant, corrosif |
| Description de la sécurité | Évitez tout contact avec l’eau, les acides, les matières organiques et les agents réducteurs. Utilisez un équipement de protection individuelle approprié. Conserver dans un récipient hermétiquement fermé à l’abri de la chaleur, de l’humidité et des sources d’ignition. En cas de contact avec les yeux, la peau ou le système respiratoire, consulter immédiatement un médecin. |
| Numéros d’identification de l’ONU | ONU 3083 |
| Code SH | 28299090 |
| Classe de danger | 5.1 (Matières comburantes) |
| Groupe d’emballage | II |
| Toxicité | Très toxique par inhalation, ingestion ou absorption cutanée. Provoque de graves brûlures et des lésions tissulaires. Peut entraîner des explosions et des risques d’incendie au contact de l’eau, de matières organiques et d’autres substances réactives. |
Méthodes de synthèse de l’heptoxyde de chlore
L’heptoxyde de chlore est un composé hautement réactif et difficile à synthétiser.
L’une des méthodes les plus courantes de synthèse de l’heptoxyde de chlore consiste à faire réagir le chlore gazeux et l’ozone. Cette réaction est exothermique et peut conduire à une réaction explosive si elle n’est pas soigneusement contrôlée.
Une autre méthode implique la réaction du chlore gazeux avec le chlorate de potassium, qui produit de l’heptoxyde de chlore et du chlorure de potassium comme sous-produits. Cette méthode nécessite également un contrôle minutieux des conditions de réaction pour empêcher la formation d’intermédiaires explosifs.
On peut synthétiser l’heptoxyde de chlore en faisant réagir du chlore gazeux avec du pentoxyde de dichlore, qui produit de l’heptoxyde de chlore et de l’hexoxyde de dichlore comme sous-produits. Cependant, les chercheurs n’utilisent pas couramment cette méthode en raison de la nature dangereuse du pentoxyde de dichlore.
D’autres méthodes de synthèse de l’heptoxyde de chlore incluent la réaction du chlore gazeux avec divers composés organiques, tels que le benzène ou le toluène, dans des conditions contrôlées. Cependant, ces méthodes nécessitent une optimisation minutieuse des conditions de réaction et ne sont pas aussi fiables ou couramment utilisées que les méthodes chlore-ozone ou chlore-chlorate de potassium.
Dans l’ensemble, la synthèse du chlore heptoxyde nécessite un contrôle minutieux des conditions de réaction et présente des risques de sécurité importants en raison de la nature hautement réactive du composé. Des précautions de sécurité et des procédures de manipulation appropriées doivent être suivies lorsque vous travaillez avec de l’heptoxyde de chlore ou toute autre substance dangereuse.
Utilisations de l’heptoxyde de chlore
- Le Cl2O7 trouve sa principale utilisation comme agent oxydant dans la synthèse chimique et la recherche.
- Il agit comme un puissant oxydant, réagissant avec un large éventail de composés organiques et inorganiques, ce qui le rend utile dans de nombreuses réactions chimiques.
- L’une des utilisations les plus courantes du Cl2O7 est la production de dioxyde de chlore, un puissant agent désinfectant et blanchissant utilisé dans le traitement de l’eau, la production de pâtes et papiers et la fabrication textile.
- Il est également utilisé comme oxydant puissant dans la synthèse de plusieurs composés organiques, notamment des produits pharmaceutiques et agrochimiques.
- Le Cl2O7 est utilisé en milieu universitaire et en recherche pour étudier la réactivité de divers composés organiques et inorganiques. Il sert également de catalyseur dans la synthèse de certains composés, comme les résines époxy et l’anhydride acétique.
- En raison de sa nature dangereuse, les applications industrielles à grande échelle n’utilisent généralement pas le Cl2O7. Il nécessite une manipulation et un stockage soigneux pour éviter la formation d’intermédiaires explosifs et d’autres risques pour la sécurité.
Dans l’ensemble, le Cl2O7 est un composé utile dans la synthèse chimique et la recherche, mais il nécessite des précautions de sécurité et des procédures de manipulation appropriées pour minimiser les risques associés à son utilisation.
Des questions:
Q : Qu’est-ce que le Cl2O7 ?
R : Cl2O7 est un composé chimique composé de deux atomes de chlore et de sept atomes d’oxygène, de formule chimique Cl2O7.
Q : Quel est le nom correct du Cl2O7 ?
R : Le nom correct pour Cl2O7 est heptoxyde de dichlore.
Q : Le Cl2O7 est-il ionique ou covalent ?
R : Cl2O7 est un composé covalent. Il est composé de deux éléments non métalliques, le chlore et l’oxygène, et forme un composé moléculaire grâce au partage d’électrons entre les atomes.
Q : Quel oxyde ci-dessous réagit avec l’eau pour former un acide faible ? MgO, Cl2O7, P4O10, Bi2O3, N2O5.
R : L’oxyde qui réagit avec l’eau pour former un acide faible est le N2O5. Lorsque le N2O5 réagit avec l’eau, il forme de l’acide nitrique, qui est un acide faible. Les autres oxydes répertoriés, MgO, P4O10, Bi2O3 et Cl2O7, ne réagissent pas avec l’eau pour former des acides faibles.
