Le chlore (Cl2) est un gaz jaune verdâtre très réactif. Il est utilisé dans le traitement de l’eau, comme désinfectant et dans la production de divers produits chimiques, comme le PVC et les solvants.
| Nom UICPA | Dichlore |
| Formule moléculaire | Cl2 |
| Numero CAS | 7782-50-5 |
| Synonymes | Chlore moléculaire, Chlore, Cloro, Chlor, Chloor, Cloreto de cloro |
| InChI | InChI=1S/Cl2/c1-2 |
Cl2 Masse molaire
La masse molaire du Cl2, ou dichlore, est la somme des masses atomiques de deux atomes de chlore, soit 70,906 g/mol. Il est important de connaître la masse molaire de Cl2 lors du calcul de la quantité de substance nécessaire à une réaction chimique ou lors de la conversion entre différentes unités de mesure.
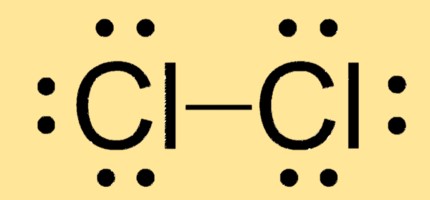
Structure de Lewis Cl2
Cl2 a une géométrie moléculaire linéaire avec deux atomes de chlore liés par une seule liaison covalente. Sa structure de Lewis se compose de deux atomes Cl avec chacun trois paires isolées et une paire d’électrons partagée entre eux.
Point d’ébullition Cl2
Le point d’ébullition du Cl2 est de -34,04°C (-29,27°F) à pression standard. Il s’agit d’un point d’ébullition relativement bas, qui produit du Cl2 gazeux à température et pression ambiantes. Il est important d’être prudent lors de la manipulation du Cl2, car il peut facilement se transformer en liquide ou en solide à basse température et pression.
Cl2 Point de fusion
Le point de fusion du Cl2 est de -101,5°C (-150,7°F) à pression standard. Il s’agit d’un point de fusion relativement bas, ce qui produit du Cl2 gazeux à température et pression ambiantes. Il est important d’être prudent lors de la manipulation du Cl2, car il peut facilement se transformer en liquide ou en solide à basse température et pression.
Cl2 Densité g/ml
La densité du Cl2 est de 0,003214 g/mL à température et pression standard (STP). Cela signifie que le Cl2 est beaucoup moins dense que l’air et qu’il s’élèvera dans l’atmosphère. Le Cl2 peut être stocké dans des bouteilles sous pression ou dans des réservoirs contenant des gaz plus lourds que l’air comme l’azote.
Poids moléculaire du chlore
Le poids moléculaire du Cl2 est de 70,906 g/mol. Il s’agit de la masse d’une mole de Cl2, qui contient le nombre de molécules d’Avogadro (6,022 x 10^23). Le poids moléculaire du Cl2 est important pour les calculs stœchiométriques en chimie.
Structure du chlore
La structure du Cl2 est linéaire, avec deux atomes de chlore liés entre eux par une liaison covalente. La longueur de liaison entre les deux atomes de chlore est de 1,99 Ångstroms et l’énergie de liaison est de 242 kJ/mol. La configuration électronique de Cl2 est [Ne]3s23p5, chaque atome de chlore apportant un électron à la paire de liaisons.
Formule de chlore
La formule du Cl2 est simplement deux atomes de Cl liés ensemble. Ceci est représenté par Cl-Cl ou Cl2. La formule est importante pour identifier la composition d’un composé ou d’une molécule et pour les calculs stœchiométriques en chimie.
| Apparence | Gaz jaune verdâtre |
| Gravité spécifique | 1,56 (liquide) |
| Couleur | Jaune verdâtre |
| Odeur | Odeur âcre et suffocante |
| Masse molaire | 70,906 g/mole |
| Densité | 0,003214 g/mL à STP |
| Point de fusion | -101,5°C (-150,7°F) |
| Point d’ébullition | -34,04°C (-29,27°F) |
| Point d’éclair | Ininflammable |
| Solubilité dans l’eau | 0,92 g/100 mL à 20°C |
| Solubilité | Soluble dans l’eau, l’éthanol, l’éther, le benzène et de nombreux solvants organiques |
| La pression de vapeur | 102,44 kPa à 20°C |
| Densité de vapeur | 2,49 (air = 1) |
| pKa | – |
| pH | – |
Cl2 Sécurité et dangers
Le chlore est un gaz hautement réactif qui peut présenter de graves risques pour la sécurité et la santé s’il n’est pas manipulé correctement. Il peut provoquer de graves irritations respiratoires et des lésions des yeux, de la peau et des muqueuses. L’inhalation de concentrations élevées de chlore peut provoquer un œdème pulmonaire, pouvant mettre la vie en danger. Le chlore est également très corrosif et peut endommager les métaux, les plastiques et d’autres matériaux. Pour garantir une manipulation sûre du chlore, un équipement de protection individuelle approprié doit être porté, tel que des lunettes, des gants et un respirateur. Le chlore ne doit être utilisé que dans des zones bien ventilées et tous les conteneurs doivent être correctement étiquetés et stockés dans un endroit sûr.
| Symboles de danger | Crâne et os croisés |
| Description de la sécurité | Gaz hautement toxique et corrosif ; provoque une grave irritation des voies respiratoires et de la peau ; peut être mortel en cas d’inhalation à des concentrations élevées |
| Numéros d’identification de l’ONU | UN1017 |
| Code SH | 2801.1 |
| Classe de danger | 2.3 |
| Groupe d’emballage | je |
| Toxicité | Très toxique ; l’inhalation de concentrations élevées peut provoquer un œdème pulmonaire et être mortelle |
Méthodes de synthèse du chlore
Il existe différentes méthodes pour synthétiser le chlore gazeux, notamment l’électrolyse de la saumure, l’oxydation du HCl et la décomposition thermique des chlorures métalliques.
La méthode la plus courante est l’électrolyse de la saumure, qui consiste à faire passer un courant électrique à travers une solution de chlorure de sodium (NaCl) et d’eau (H2O). Ce processus génère du chlore gazeux à l’anode et de l’hydrogène gazeux à la cathode.
Une autre méthode de production de chlore est l’oxydation du HCl avec un agent oxydant, tel que KMnO4 ou MnO2. Cette réaction produit du chlore gazeux et de l’eau comme sous-produits.
La décomposition thermique des chlorures métalliques, tels que MgCl2 ou FeCl3, est une autre méthode de génération de chlore gazeux. Ce processus consiste à chauffer le chlorure métallique à une température élevée, ce qui le provoque à se décomposer et à libérer du chlore gazeux.
Dans l’ensemble, la méthode de synthèse utilisée pour le chlore dépend de l’application spécifique et de la pureté souhaitée du gaz. Quelle que soit la méthode utilisée, il est important de manipuler le chlore avec prudence en raison de sa nature hautement réactive et toxique.
Utilisations du chlore
Le chlore gazeux a un large éventail d’utilisations dans diverses industries. L’une des principales utilisations du chlore est la production de chlorure de polyvinyle (PVC), une matière plastique largement utilisée. Le chlore est également utilisé dans la production d’autres composés chlorés, tels que le chloroforme et le tétrachlorure de carbone, qui sont utilisés comme solvants et dans la fabrication de réfrigérants.
Dans l’industrie du traitement de l’eau, le chlore est couramment utilisé comme désinfectant pour traiter l’eau potable et les eaux usées. Le chlore gazeux est efficace pour tuer les bactéries et les virus, et il peut également oxyder et éliminer les composés organiques et autres contaminants de l’eau.
Dans l’industrie des pâtes et papiers, le chlore gazeux est utilisé comme agent de blanchiment pour blanchir les produits en papier. Il est également utilisé dans la production de textiles, comme le nylon et le polyester, ainsi que dans la fabrication de colorants et de pigments.
Le chlore gazeux a également d’autres applications, notamment dans la production de certains produits pharmaceutiques et dans l’industrie métallurgique pour le décapage et le nettoyage des surfaces métalliques. Cependant, en raison de sa nature dangereuse, le chlore doit être manipulé avec précaution et des précautions de sécurité appropriées doivent être prises lors de son stockage, de son transport et de son utilisation.
Des questions:
Q : Le Cl2 est-il polaire ou non polaire ?
R : Cl2 est une molécule non polaire.
Q : Le chlore est-il un métal ?
R : Non, le chlore n’est pas un métal. C’est un halogène et appartient au groupe d’éléments non métalliques.
Q : Quel métal mou se combine avec le chlore pour fabriquer du sel de table ?
R : Le sodium (Na) est le métal mou qui se combine avec le chlore (Cl) pour produire du sel de table (NaCl).
Q : Comment faire la chloration de l’eau ?
R : La chloration de l’eau se fait généralement en ajoutant une quantité mesurée de chlore gazeux, d’hypochlorite de sodium ou d’hypochlorite de calcium à l’alimentation en eau. La quantité de chlore ajoutée dépend de la qualité de l’eau et du niveau de désinfection souhaité. Le chlore réagit avec les bactéries et autres micro-organismes présents dans l’eau, les tuant efficacement et rendant l’eau propre à la consommation.
Q : Lequel des éléments suivants est traité avec du chlore pour obtenir de la poudre décolorante ?
R : L’oxyde de calcium (CaO) est traité avec du chlore (Cl2) pour obtenir de la poudre décolorante (CaOCl2).
