Le dichlorométhane (CH2Cl2) ou chlorure de méthylène dissout une large gamme de composés organiques et est couramment utilisé comme solvant dans les laboratoires de chimie. Il peut également être utilisé dans les procédés de décapage et de dégraissage de peinture.
| Nom UICPA | Dichlorométhane |
| Formule moléculaire | CH2Cl2 |
| Numero CAS | 75-09-2 |
| Synonymes | Chlorure de méthylène, dichlorure de méthylène, DCM, Narkotil, Solaesthin, Solmethine, etc. |
| InChI | InChI=1S/CH2Cl2/c2-1-3/h1H2 |
Dichlorométhane Densité g/ml
La densité du dichlorométhane est de 1,326 g/mL. Cette valeur indique la masse de dichlorométhane par unité de volume à une température et une pression données. La densité du dichlorométhane est relativement élevée, ce qui en fait un liquide plus dense que l’eau. Cette propriété le rend utile dans certaines applications de laboratoire, où il peut être utilisé pour séparer des substances de différentes densités.
Point d’ébullition du dichlorométhane
Le point d’ébullition du dichlorométhane est de 39,6 °C (103,3 °F). Cette température indique le point auquel la forme liquide du dichlorométhane passera à son état gazeux. Le faible point d’ébullition du dichlorométhane en fait un composé très volatil qui peut facilement se vaporiser à température ambiante. Cette propriété le rend utile comme solvant dans de nombreuses applications en laboratoire, où il peut être facilement évaporé.
Dichlorométhane Masse molaire
La masse molaire du dichlorométhane, également appelé chlorure de méthylène, est de 84,93 g/mol. Cette valeur est obtenue en additionnant les masses atomiques des atomes d’une seule molécule de dichlorométhane. La formule moléculaire du dichlorométhane est CH2Cl2, ce qui indique qu’il contient un atome de carbone, deux atomes d’hydrogène et deux atomes de chlore. La masse molaire est une propriété importante pour déterminer la quantité d’une substance présente dans un échantillon donné.
Dichlorométhane Point de fusion
Le point de fusion du CH2Cl2 est de -97,4 °C (-143,3 °F). Cette température indique le point auquel la forme solide du CH2Cl2 passera à son état liquide. Cependant, le CH2Cl2 se trouve rarement sous sa forme solide, car il s’agit d’un liquide volatil à température ambiante. Le faible point de fusion du CH2Cl2 rend sa congélation difficile et il reste liquide même à basse température.
Dichlorométhane Poids moléculaire
Le poids moléculaire du CH2Cl2 est de 84,93 g/mol. Cette valeur est la somme des poids atomiques des atomes d’une seule molécule de CH2Cl2. Le poids moléculaire est une propriété importante pour déterminer la quantité d’une substance présente dans un échantillon donné.
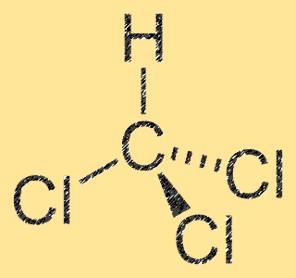
Structure du dichlorométhane
CH2Cl2 a une structure moléculaire tétraédrique, avec un atome de carbone central lié à deux atomes de chlore et à deux atomes d’hydrogène. La molécule a un moment dipolaire, qui résulte de la différence d’électronégativité entre les atomes de carbone et de chlore. L’atome de carbone a une charge partiellement positive, tandis que les atomes de chlore ont une charge partielle négative. Cette propriété fait du CH2Cl2 une molécule polaire.
Formule dichlorométhane
La formule moléculaire du dichlorométhane est CH2Cl2. La formule indique que la molécule contient un atome de carbone, deux atomes d’hydrogène et deux atomes de chlore. La formule fournit également des informations sur le nombre relatif d’atomes dans une seule molécule de dichlorométhane. La formule est utile pour déterminer la stœchiométrie des réactions chimiques impliquant le dichlorométhane.
| Apparence | Liquide incolore |
| Gravité spécifique | 1.326 |
| Couleur | Incolore |
| Odeur | Odeur douce, semblable à celle du chloroforme |
| Masse molaire | 84,93 g/mole |
| Densité | 1,326 g/mL |
| Point de fusion | -97,4 °C (-143,3 °F) |
| Point d’ébullition | 39,6 °C (103,3 °F) |
| Point d’éclair | -22 °C (-8 °F) |
| Solubilité dans l’eau | 16,5 g/L à 20 °C (68 °F) |
| Solubilité | Miscible avec de nombreux solvants organiques |
| Pression de vapeur | 44,6 kPa à 20 °C (68 °F) |
| Densité de vapeur | 2,93 |
| pKa | 4 |
| pH | Neutre |
Sécurité et dangers du dichlorométhane
Le dichlorométhane (CH2Cl2), également connu sous le nom de chlorure de méthylène, est un produit chimique dangereux qui présente des risques importants pour la sécurité s’il n’est pas manipulé correctement. Il est hautement inflammable et peut provoquer des incendies ou des explosions s’il est exposé à la chaleur ou à des flammes nues. L’inhalation de ses vapeurs peut provoquer une irritation respiratoire, des maux de tête, des étourdissements et même une perte de conscience. Le contact cutané avec le CH2Cl2 peut provoquer une irritation, des brûlures ou des brûlures chimiques. C’est également un cancérigène potentiel, une exposition à long terme augmentant le risque de cancer du foie et du poumon. Des précautions de sécurité appropriées, telles que l’utilisation d’un équipement de protection individuelle approprié et le travail dans un endroit bien ventilé, sont essentielles lorsque l’on travaille avec du CH2Cl2.
| Symboles de danger | Xn,F |
| Description de la sécurité | Liquide et vapeurs hautement inflammables. Nocif en cas d’ingestion, inhalation ou absorption par la peau. Provoque une irritation cutanée et une grave irritation des yeux. Peut provoquer une irritation respiratoire. Peut provoquer somnolence ou vertiges. Peut être mortel en cas d’ingestion et de pénétration dans les voies respiratoires. |
| Identifiants ONU | ONU 1593 |
| Code SH | 29031200 |
| Classe de danger | 3 |
| Groupe d’emballage | II |
| Toxicité | Le dichlorométhane est classé comme cancérogène de catégorie 2 et a été associé au cancer du foie et du poumon. Il est également connu pour provoquer une dépression du système nerveux central et peut être mortel s’il est ingéré ou inhalé à fortes concentrations. Des précautions de sécurité appropriées doivent toujours être prises lorsque vous travaillez avec du dichlorométhane. |
Méthodes de synthèse du dichlorométhane
Il existe plusieurs méthodes pour synthétiser le dichlorométhane (CH2Cl2), un liquide incolore utilisé comme solvant et décapant pour peinture. Une méthode courante implique la réaction du méthane gazeux avec du chlore gazeux en présence d’un catalyseur, généralement du chlorure d’aluminium ou du chlorure ferrique. La réaction produit à la fois du CH2Cl2 et du chlorure d’hydrogène gazeux comme sous-produits. Une autre méthode implique la chloration du méthanol avec du chlorure d’hydrogène gazeux ou du chlorure de thionyle. Cette réaction produit également du CH2Cl2 comme produit, ainsi que de l’eau ou du dioxyde de soufre comme sous-produits.
Une autre méthode implique la réaction du chloroforme avec le zinc en présence d’acide chlorhydrique. Cette réaction produit à la fois du CH2Cl2 et du chlorure de zinc comme produits, avec de l’hydrogène gazeux comme sous-produit.
La chloration de divers composés organiques, tels que l’éthane ou le propane, en présence d’un catalyseur peut produire du CH2Cl2 comme sous-produit.
Quelle que soit la méthode utilisée, il est important de manipuler le CH2Cl2 avec précaution en raison de ses propriétés dangereuses. Lors de la synthèse et de la manipulation du CH2Cl2, il est important de prendre des précautions de sécurité appropriées, comme porter un équipement de protection individuelle approprié et travailler dans un endroit bien ventilé.
Utilisations du dichlorométhane
Le dichlorométhane, également connu sous le nom de chlorure de méthylène, trouve de nombreuses applications dans l’industrie et la recherche en tant que solvant organique polyvalent. Il joue un rôle crucial dans la production de produits pharmaceutiques et de revêtements tels que les peintures et vernis. De plus, c’est un agent nettoyant utile dans les industries de la fabrication électronique et de la métallurgie pour le dégraissage.
Le dichlorométhane dissout et élimine de nombreux types de peinture et de revêtements, ce qui en fait un décapant populaire. Son utilisation comme agent gonflant dans la production de mousses de polyuréthane, de résines de polycarbonate et d’autres plastiques est également remarquable.
Outre ses utilisations industrielles, le dichlorométhane est précieux dans l’extraction de produits naturels tels que les huiles essentielles et les parfums à partir de matières végétales. C’est également un solvant efficace pour de nombreux composés organiques utilisés dans les réactifs de laboratoire en synthèse organique.
Cependant, le dichlorométhane nécessite une manipulation prudente en raison de ses propriétés dangereuses telles que l’inflammabilité et la toxicité. Il est important de prendre les précautions de sécurité appropriées, notamment en travaillant dans un endroit bien ventilé et en portant un équipement de protection individuelle approprié lorsque vous travaillez avec du dichlorométhane.
Des questions:
Q : Le dichlorométhane est-il polaire ?
R : Oui, le dichlorométhane est un solvant polaire.
Q : Parmi les risques suivants, lesquels sont associés au dichlorométhane ?
R : Les dangers associés au dichlorométhane comprennent son inflammabilité, sa toxicité et son potentiel d’irritation cutanée et respiratoire.
Q : Le dichlorométhane est-il inflammable ?
R : Oui, le dichlorométhane est inflammable et peut provoquer des incendies ou des explosions s’il est exposé à la chaleur ou à des flammes nues.
Q : Le dichlorométhane est-il soluble dans l’eau ?
R : Oui, le dichlorométhane est légèrement soluble dans l’eau. Cependant, il est principalement utilisé comme solvant pour les composés non polaires et n’est pas couramment utilisé dans les solutions aqueuses.
