Le néopentane est un hydrocarbure hautement ramifié avec quatre groupes méthyle attachés à un atome de carbone central. Il est couramment utilisé comme composé de référence en spectroscopie RMN et comme additif pour carburant.
| Nom UICPA | 2,2-diméthylpropane |
| Formule moléculaire | C5H12 |
| Numero CAS | 463-82-1 |
| Synonymes | Diméthylpropane, tétraméthylméthane, 2,2-diméthylpropane, Neo-C5H12, UN 2043 |
| InChI | InChI=1S/C5H12/c1-5(2,3)4/h1-4H3 |
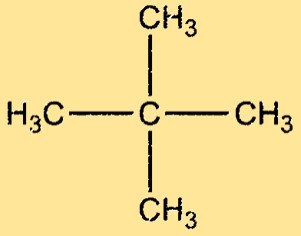
Structure en néopentane
Le néopentane a une structure très ramifiée, avec quatre groupes méthyle attachés à un atome de carbone central. La molécule est symétrique et tétraédrique, avec un angle de liaison de 109,5° entre chaque paire d’atomes de carbone adjacents. La molécule de néopentane est apolaire, avec seulement de faibles forces de Van der Waals entre ses molécules.
Point d’ébullition du néopentane
Le point d’ébullition du néopentane est de -9,5°C (-15°F) à pression standard. Ce faible point d’ébullition est dû aux faibles forces intermoléculaires entre ses molécules, ce qui le rend relativement facile à vaporiser. Le néopentane est un gaz incolore à température et pression ambiantes, et il est couramment utilisé comme composé de référence pour la chromatographie en phase gazeuse.
Néopentane Masse molaire
Le néopentane, également connu sous le nom de 2,2-diméthylpropane, a une masse molaire de 72,15 g/mol. C’est un hydrocarbure hautement ramifié avec quatre groupes méthyle attachés à un atome de carbone central. La masse molaire du néopentane peut être calculée en additionnant les poids atomiques de tous les atomes de sa formule moléculaire, qui est C5H12.
Néopentane Point de fusion
Le point de fusion du néopentane est de -16,6°C (2°F) à pression standard. Tout comme son point d’ébullition, le faible point de fusion du néopentane résulte de ses faibles forces intermoléculaires. Le néopentane est une molécule non polaire avec seulement de faibles forces de Van der Waals entre ses molécules, il ne forme donc pas de structures cristallines fortes.
Néopentane Densité g/ml
La densité du néopentane est de 0,623 g/mL à température et pression standard. Cette faible densité est due au faible poids moléculaire du néopentane, qui n’est que de 72,15 g/mol. Le néopentane est moins dense que l’eau, il flottera donc à la surface de l’eau si les deux sont mélangés.
Néopentane Poids moléculaire
Le poids moléculaire du tétraméthylméthane est de 72,15 g/mol. Cette valeur représente la somme des poids atomiques de tous les atomes de la molécule, composée de cinq atomes de carbone et de 12 atomes d’hydrogène. Le faible poids moléculaire du tétraméthylméthane en fait un composé hautement volatil et inflammable.
Formule tétraméthylméthane
La formule moléculaire du tétraméthylméthane est C5H12, qui représente le nombre et les types d’atomes présents dans la molécule. La formule indique qu’il y a cinq atomes de carbone et 12 atomes d’hydrogène dans la molécule de tétraméthylméthane. La formule moléculaire ne fournit pas d’informations sur la disposition des atomes au sein de la molécule, qui est déterminée par sa structure.
| Apparence | Gaz incolore |
| Gravité spécifique | 0,623 g/mL à 20°C |
| Couleur | Incolore |
| Odeur | Inodore |
| Masse molaire | 72,15 g/mole |
| Densité | 0,623 g/mL à 20°C |
| Point de fusion | -16,6°C |
| Point d’ébullition | -9,5°C |
| Point d’éclair | -49°C |
| Solubilité dans l’eau | 0,04 g/L à 20°C |
| Solubilité | Insoluble dans l’eau |
| La pression de vapeur | 566 mmHg à 20°C |
| Densité de vapeur | 2,5 (air = 1) |
| pKa | ~50 |
| pH | N’est pas applicable |
Sécurité et dangers du néopentane
Le tétraméthylméthane est un gaz hautement inflammable et peut former des mélanges explosifs avec l’air. Il peut également provoquer des engelures s’il entre en contact avec la peau, car son point d’ébullition est très bas, à -9,5°C. L’inhalation de gaz tétraméthylméthane peut provoquer des étourdissements, des nausées et des maux de tête. Il est important de manipuler le tétraméthylméthane avec précaution et d’éviter toute exposition aux flammes, aux étincelles ou à d’autres sources d’inflammation. Le tétraméthylméthane doit être stocké dans un endroit frais, sec et bien ventilé, à l’abri de la chaleur et des agents oxydants. Un équipement de protection individuelle approprié, tel que des gants et des lunettes, doit être porté lors de la manipulation du tétraméthylméthane.
| Symboles de danger | F+ |
| Description de la sécurité | Gaz hautement inflammable. Peut provoquer des engelures. Utiliser uniquement dans un endroit bien ventilé. Tenir à l’écart de la chaleur et des sources d’ignition. Portez des gants et des lunettes de protection. |
| ID ONU | UN2451 |
| Code SH | 2901.1 |
| Classe de danger | 2.1 |
| Groupe d’emballage | Aucun |
| Toxicité | Faible toxicité |
Méthodes de synthèse du néopentane
Il existe plusieurs méthodes différentes pour synthétiser le tétraméthylméthane.
Une méthode courante implique la réaction de l’isobutène et du formaldéhyde sur un catalyseur acide solide, tel que la zéolite. La réaction produit de l’alcool néopentylique, que l’on peut ensuite déshydrater pour donner du tétraméthylméthane.
Une autre méthode de synthèse du tétraméthylméthane implique la décomposition thermique du 2,2-diméthylpropane à haute température. Cette réaction produit du tétraméthylméthane et d’autres hydrocarbures.
Une troisième méthode implique la réaction du chlorure d’éthyle et du zinc en présence de magnésium pour produire du diéthylzinc, qui peut ensuite réagir avec l’isobutylène pour produire du tétraméthylméthane.
On peut synthétiser le tétraméthylméthane en hydrogénant l’isopentène, qui résulte de la déshydrogénation de l’isopentane.
En fonction de divers facteurs tels que la disponibilité des matières premières, le coût, le rendement et la pureté souhaités du produit final, différentes méthodes de synthèse du tétraméthylméthane peuvent être adaptées.
Utilisations du néopentane
Le tétraméthylméthane a plusieurs applications industrielles et scientifiques importantes.
- Il est utilisé comme matériau de référence pour la chromatographie en phase gazeuse, grâce à sa grande pureté et ses propriétés bien définies.
- Le tétraméthylméthane est également utilisé comme étalon pour les mesures calorimétriques et thermodynamiques.
- Une autre utilisation majeure du tétraméthylméthane est celle comme agent gonflant dans la production de mousses de polyuréthane, utilisées dans une large gamme d’applications, telles que l’isolation, le rembourrage et l’emballage.
- Il est utilisé comme réfrigérant dans les systèmes de refroidissement, en raison de son faible point d’ébullition et de ses bonnes propriétés thermodynamiques. Cependant, son utilisation comme réfrigérant a été largement abandonnée en raison de sa haute inflammabilité et de ses impacts environnementaux potentiels.
- Le tétraméthylméthane est également utilisé dans la synthèse d’autres composés organiques, tels que le néopentylglycol, utilisé dans la production de résines, de revêtements et de plastiques.
Ses propriétés uniques en font un composé polyvalent et précieux pour diverses applications industrielles et scientifiques. Cependant, les dangers potentiels du tétraméthylméthane doivent être soigneusement examinés et gérés afin de garantir une utilisation sûre et responsable.
Des questions:
Q : Combien d’atomes de carbone chiraux le néopentane (2,2-diméthylpropane) possède-t-il ?
R : Le néopentane ne possède aucun atome de carbone chiral. C’est une molécule symétrique avec une géométrie tétraédrique autour de chaque atome de carbone, donc tous les atomes de carbone sont équivalents.
Q : Lequel a le point d’ébullition le plus élevé : l’hexane, le pentane ou le néopentane ?
R : L’hexane a le point d’ébullition le plus élevé, suivi du pentane puis du néopentane. En effet, le point d’ébullition d’un hydrocarbure augmente avec son poids moléculaire et sa surface spécifique, ainsi qu’avec la force de ses forces intermoléculaires. L’hexane a le poids moléculaire et la surface spécifique les plus élevés parmi les trois composés et possède également les forces intermoléculaires les plus fortes en raison de sa structure linéaire, conduisant à un point d’ébullition plus élevé. Le pentane et le néopentane ont des points d’ébullition plus bas en raison de leur taille moléculaire plus petite et de leurs forces intermoléculaires plus faibles.
