Le phosphate de sodium dibasique ou Na2HPO4 est un composé couramment utilisé comme agent tampon en laboratoire. On peut également le trouver dans certains produits alimentaires et boissons comme additif alimentaire.
| Nom UICPA | Hydrogénophosphate disodique |
| Formule moléculaire | Na2HPO4 |
| Numero CAS | 7558-79-4 |
| Synonymes | Hydrogénophosphate de sodium, Phosphate disodique, Phosphate de sodium dibasique, Phosphate de sodium dibasique anhydre, Phosphate de sodium dibasique heptahydraté |
| InChI | InChI=1S/2Na.H3O4P/c;;1-5(2,3)4/h;;(H3,1,2,3,4)/q2*+1;/p-2 |
Na2HPO4 masse molaire
La masse molaire du phosphate de sodium dibasique est 141,96 g/mol. Cette valeur est calculée en additionnant les masses atomiques de chacun des éléments présents dans le composé, qui sont le sodium (Na), le phosphore (P) et l’oxygène (O). La masse molaire est un paramètre important utilisé dans divers calculs, par exemple pour déterminer la quantité d’une substance nécessaire pour effectuer une réaction ou pour préparer une solution d’une certaine concentration.
Formule de phosphate disodique
La formule chimique du phosphate de sodium dibasique est Na2HPO4. Cette formule représente le rapport de chacun des éléments présents dans le composé. La formule est importante pour déterminer les propriétés chimiques du composé, telles que sa réactivité et sa solubilité.
Point d’ébullition dibasique du phosphate de sodium
Le phosphate de sodium dibasique n’a pas de point d’ébullition défini car il se décompose avant d’atteindre son point d’ébullition. Cependant, la température de décomposition du phosphate de sodium dibasique serait d’environ 155°C. À des températures supérieures à cette valeur, le composé commence à se décomposer en ses ions constitutifs, le sodium et le phosphate. Cette propriété le rend impropre à une utilisation dans des applications nécessitant un chauffage à des températures élevées.
Point de fusion du phosphate de sodium dibasique
Le point de fusion du Na2HPO4 varie selon la forme sous laquelle il est présent. La forme anhydre du composé a un point de fusion de 358°C, tandis que la forme heptahydratée a un point de fusion inférieur de 93°C. Le point de fusion est une propriété physique importante utilisée pour identifier et caractériser les substances.
Densité dibasique du phosphate de sodium g/ml
La densité de Na2HPO4 dépend de la forme sous laquelle il est présent. La forme anhydre du composé a une densité de 1,7 g/mL, tandis que la forme heptahydratée a une densité plus faible de 1,68 g/mL. La densité est une propriété physique qui décrit la quantité de masse contenue dans un certain volume d’une substance.
Poids moléculaire dibasique du phosphate de sodium
Le poids moléculaire de Na2HPO4 est de 141,96 g/mol. Cette valeur est calculée en additionnant les masses atomiques de chacun des éléments présents dans le composé. Le poids moléculaire est un paramètre important utilisé dans divers calculs, par exemple pour déterminer la quantité d’une substance nécessaire pour effectuer une réaction ou pour préparer une solution d’une certaine concentration.
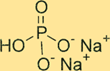
Structure dibasique du phosphate de sodium
Na2HPO4 a une structure cristalline. La forme anhydre du composé est une poudre blanche et inodore, tandis que la forme heptahydratée est un cristal incolore et transparent. Le composé a une forme tétraédrique autour de l’atome de phosphore, chaque atome d’oxygène étant situé aux coins du tétraèdre. Les ions sodium sont situés dans les espaces interstitiels entre les tétraèdres.
| Apparence | Poudre blanche ou cristaux transparents |
| Gravité spécifique | 1,68 – 1,7 g/mL |
| Couleur | Incolore à blanc |
| Odeur | Inodore |
| Masse molaire | 141,96 g/mole |
| Densité | 1,68 – 1,7 g/mL |
| Point de fusion | Anhydre : 358°C, Heptahydraté : 93°C |
| Point d’ébullition | Se décompose avant de bouillir |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Très soluble |
| Solubilité | Soluble dans l’eau, insoluble dans l’éthanol |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| PKa | 2,15 (ion phosphate) |
| PH | 8,0 – 11,0 (solution aqueuse 0,1 M) |
Sécurité et dangers du phosphate de sodium dibasique
Le phosphate de sodium dibasique (Na2HPO4) est généralement considéré comme sûr pour une utilisation dans diverses applications, mais il peut provoquer une irritation de la peau et des yeux. L’inhalation du composé sous forme de poudre peut provoquer une irritation respiratoire. Na2HPO4 peut réagir violemment avec des acides forts et des agents oxydants, et peut libérer des fumées toxiques lorsqu’il est chauffé à des températures élevées. Comme pour tous les produits chimiques, des précautions appropriées doivent être prises lors de la manipulation de ce composé, comme porter des vêtements et des gants de protection et travailler dans un endroit bien ventilé. En cas de contact avec la peau ou les yeux, rincer abondamment à l’eau et consulter un médecin si nécessaire.
| Symboles de danger | Aucun |
| Description de la sécurité | S22 – Ne pas respirer les poussières, S24 – Éviter le contact avec la peau, S37 – Porter des gants adaptés |
| Identifiants ONU | UN3077 |
| Code SH | 28352200 |
| Classe de danger | 9 |
| Groupe d’emballage | III |
| Toxicité | DL50 (rat, orale) – 3 400 mg/kg |
Méthodes de synthèse du phosphate de sodium dibasique
Le phosphate de sodium dibasique (Na2HPO4) peut être synthétisé par plusieurs méthodes, notamment la réaction de l’acide phosphorique avec de l’hydroxyde de sodium, la neutralisation de l’acide phosphorique avec du carbonate ou du bicarbonate de sodium et la réaction du phosphate de sodium monobasique avec de l’hydroxyde de sodium.
- Une méthode courante consiste à faire réagir l’acide phosphorique avec de l’hydroxyde de sodium dans un rapport de 1:2 pour produire du Na2HPO4 et de l’eau. La réaction peut être effectuée à température ambiante ou sous chauffage doux, et le produit résultant est purifié par cristallisation ou évaporation.
- Une autre méthode consiste à neutraliser l’acide phosphorique avec du carbonate ou du bicarbonate de sodium, suivi d’une précipitation du Na2HPO4. Le pH du mélange réactionnel est ajusté à environ 8-9 à l’aide de carbonate ou de bicarbonate de sodium, et le précipité résultant est collecté et lavé à l’eau pour éliminer toutes impuretés.
- Une troisième méthode consiste à faire réagir du phosphate de sodium monobasique avec de l’hydroxyde de sodium dans un rapport 1:1, entraînant la formation de Na2HPO4 et d’eau. Le produit résultant est ensuite purifié par cristallisation ou évaporation.
Le choix de la méthode dépend de facteurs tels que la pureté souhaitée, le rendement et la rentabilité. La synthèse de Na2HPO4 peut être réalisée par plusieurs méthodes, chacune ayant ses propres avantages et limites.
Utilisations du phosphate de sodium dibasique
Le phosphate de sodium dibasique trouve de nombreuses applications dans différentes industries.
- L’industrie alimentaire l’utilise comme émulsifiant, tampon et agent épaississant. Il agit comme un séquestrant, aidant à préserver la qualité et la stabilité des aliments en empêchant les ions métalliques de réagir avec d’autres composants alimentaires. Il sert d’agent levant dans les levures chimiques et d’ajusteur de pH dans les produits laitiers.
- L’industrie médicale l’utilise comme laxatif pour traiter la constipation en augmentant la teneur en eau du côlon. Il est également utilisé dans la préparation de médicaments et d’injections comme ajusteur de pH et tampon.
- Dans l’industrie agricole, il agit comme engrais, fournissant du phosphore aux plantes.
- Il fonctionne également comme complément nutritif dans l’alimentation animale.
- L’industrie du traitement de l’eau utilise Na2HPO4 comme inhibiteur de corrosion et inhibiteur de tartre dans les chaudières et les systèmes de refroidissement.
- Il agit comme un agent nettoyant, éliminant les dépôts de calcium et de magnésium des surfaces.
Des questions:
Q : Le phosphate de sodium dibasique est-il un conservateur ?
R : Na2HPO4 n’est généralement pas utilisé comme conservateur dans les produits alimentaires. Cependant, il peut agir comme un séquestrant, ce qui peut aider à préserver la qualité et la stabilité des aliments en empêchant les ions métalliques de réagir avec d’autres composants alimentaires.
Q : Combien de moles de phosphate de sodium dibasique (mw 141,98) y a-t-il dans 50 ml d’une solution à 20 % p/v ?
R : Pour calculer le nombre de moles dans une solution à 20 % p/v de Na2HPO4, nous devons d’abord convertir le pourcentage poids/volume en grammes/100 ml. Une solution à 20 % p/v signifie 20 grammes de composé dans 100 ml de solution. Par conséquent, 50 ml de solution contiennent 10 grammes de Na2HPO4. Pour calculer le nombre de moles, on divise la masse par le poids moléculaire :
moles = masse / poids moléculaire moles = 10 g / 141,98 g/mol moles = 0,070 moles
Par conséquent, il y a 0,070 mole de Na2HPO4 dans 50 ml d’une solution à 20 % p/v.
Q : Quelle est la densité du phosphate de sodium dibasique ?
R : La densité de Na2HPO4 dépend de la forme et de la concentration du composé. La forme anhydre a une densité d’environ 2,36 g/cm³, tandis que la forme heptahydratée a une densité d’environ 1,62 g/cm³. En solution, la densité variera en fonction de la concentration.
