Le chlorure d’aluminium ou AlCl3 est un composé chimique utilisé dans divers procédés industriels. Il agit comme un acide de Lewis, catalysant les réactions de synthèse organique et de polymérisation. Il possède également des propriétés anti-transpirantes dans les produits de soins personnels.
| Nom UICPA | Trichlorure d’aluminium |
| Formule moléculaire | AlCl3 |
| Numero CAS | 7446-70-0 |
| Synonymes | Trichlorure d’aluminium, chlorure d’aluminium (III), chlorure d’aluminium (III), chlorure d’aluminium, trichloroaluminium |
| InChI | InChI=1S/3ClH.Al/h3*1H;/q;;;+3/p-3 |
Formule de chlorure d’aluminium
La formule chimique du chlorure d’aluminium est AlCl3. Cette formule représente le nombre d’atomes de chaque élément de la molécule. La formule du chlorure d’aluminium est importante car elle est utilisée pour identifier la substance et calculer ses propriétés. La formule est également utilisée dans les équations chimiques pour représenter les réactifs et les produits d’une réaction chimique.
Masse molaire du chlorure d’aluminium
Le chlorure d’aluminium a une masse molaire de 133,34 g/mol. Cette valeur est calculée en additionnant la masse atomique d’un atome d’aluminium et de trois atomes de chlore. La formule moléculaire du chlorure d’aluminium est AlCl3, ce qui signifie qu’il contient un atome d’aluminium et trois atomes de chlore. La masse molaire est une propriété importante du chlorure d’aluminium car elle est utilisée dans de nombreuses réactions chimiques et procédés industriels. La masse molaire est également utilisée pour calculer la quantité d’une substance présente dans un échantillon donné.
Point d’ébullition du chlorure d’aluminium
Le point d’ébullition du chlorure d’aluminium est de 180,8 °C (357,4 °F). Cette valeur est la température à laquelle la forme liquide du chlorure d’aluminium passe à l’état gazeux. Le point d’ébullition du chlorure d’aluminium est relativement élevé, ce qui le rend utile dans de nombreux processus industriels nécessitant des températures élevées. Par exemple, le chlorure d’aluminium est utilisé comme catalyseur dans la fabrication du polypropylène, un polymère thermoplastique.
Point de fusion du chlorure d’aluminium
Le point de fusion du chlorure d’aluminium est de 194 °C (381,2 °F). Cette valeur est la température à laquelle la forme solide du chlorure d’aluminium passe à l’état liquide. Le point de fusion du chlorure d’aluminium est relativement bas, ce qui signifie qu’il peut facilement être fondu et utilisé dans diverses réactions chimiques et procédés industriels. Par exemple, le chlorure d’aluminium est utilisé comme coagulant dans l’industrie du traitement de l’eau.
Densité du chlorure d’aluminium g/ml
La densité du chlorure d’aluminium est de 2,44 g/cm3. Cette valeur est la masse de chlorure d’aluminium par unité de volume. La densité du chlorure d’aluminium est importante car elle détermine la masse d’un volume donné de la substance. La densité du chlorure d’aluminium est également utilisée pour calculer la concentration de la substance dans une solution.
Structure en chlorure d’aluminium
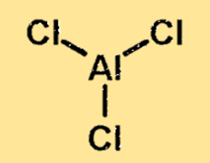
La structure du chlorure d’aluminium est une molécule liée de manière covalente avec un atome d’aluminium et trois atomes de chlore. L’atome d’aluminium est situé au centre de la molécule, entouré des trois atomes de chlore. La structure du chlorure d’aluminium est importante car elle détermine les propriétés physiques et chimiques de la substance.
Poids moléculaire du chlorure d’aluminium
Le poids moléculaire du chlorure d’aluminium est de 133,34 g/mol. Cette valeur est la somme des poids atomiques des atomes de la molécule. Le poids moléculaire du chlorure d’aluminium est important car il est utilisé pour calculer la quantité d’une substance présente dans un échantillon donné. Cette valeur est également utilisée pour déterminer la concentration molaire d’une solution.
| Apparence | Solide ou poudre blanc à jaune |
| Gravité spécifique | 2,44 g/cm3 |
| Couleur | Incolore à jaune pâle |
| Odeur | Inodore |
| Masse molaire | 133,34 g/mole |
| Densité | 2,44 g/cm3 |
| Point de fusion | 194 °C (381,2 °F) |
| Point d’ébullition | 180,8 °C (357,4 °F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Très soluble dans l’eau |
| Solubilité | Soluble dans l’éthanol, le méthanol et l’éther |
| Pression de vapeur | 2,67 kPa à 25 °C |
| Densité de vapeur | 4,45 (air = 1) |
| pKa | -6 |
| pH | 2,0 (10 g/L, H2O) |
Sécurité et dangers du chlorure d’aluminium
Le chlorure d’aluminium présente plusieurs risques pour la sécurité et la santé. Il est corrosif et peut provoquer une grave irritation de la peau et des yeux, ainsi qu’une irritation des voies respiratoires et digestives en cas d’ingestion ou d’inhalation. Il peut également provoquer des brûlures s’il entre en contact avec la peau. Le chlorure d’aluminium est un agent oxydant puissant et peut réagir violemment avec l’eau, libérant du chlorure d’hydrogène gazeux. Il est également incompatible avec de nombreux composés organiques, tels que les alcools et les amines, et peut réagir avec eux pour produire des gaz dangereux. Un équipement de protection approprié, notamment des gants, des lunettes et un respirateur, doit être porté lors de la manipulation du chlorure d’aluminium.
| Symboles de danger | Corrosif, nocif |
| Description de la sécurité | Eviter le contact avec la peau et les yeux. Porter des gants de protection et une protection pour les yeux/le visage. En cas de contact, rincer abondamment à l’eau et consulter un médecin. Ne pas ingérer ni inhaler. Utiliser dans un endroit bien ventilé. Conserver dans un endroit frais et sec, à l’écart des matières incompatibles. |
| Numéros d’identification de l’ONU | ONU 1726 |
| Code SH | 2827.32.00 |
| Classe de danger | 8 |
| Groupe d’emballage | III |
| Toxicité | Toxique en cas d’ingestion ou d’inhalation. Provoque une grave irritation de la peau et des yeux. Peut provoquer une irritation des voies respiratoires et digestives. Peut réagir violemment avec l’eau, libérant du chlorure d’hydrogène gazeux. Incompatible avec de nombreux composés organiques, tels que les alcools et les amines, et peut réagir avec eux pour produire des gaz dangereux. |
Méthodes de synthèse du chlorure d’aluminium
On peut synthétiser le chlorure d’aluminium par diverses méthodes telles que la synthèse directe, l’hydrolyse et la réaction de l’aluminium avec le chlorure d’hydrogène.
- La synthèse directe implique la réaction de l’aluminium avec du chlore gazeux à des températures élevées, généralement autour de 700-800 °C. La réaction de l’aluminium avec le chlorure d’hydrogène génère du chlorure d’aluminium en phase gazeuse, que l’on peut condenser sous forme liquide.
- L’hydrolyse implique la réaction de l’aluminium métallique avec de l’acide chlorhydrique ou de l’eau, qui produit de l’hydrogène gazeux et du chlorure d’aluminium. La réaction d’hydrolyse est généralement exothermique et peut être dangereuse si elle n’est pas conduite correctement.
- La réaction de l’aluminium avec le chlorure d’hydrogène gazeux est une autre méthode de synthèse du chlorure d’aluminium. Cette réaction a lieu à température ambiante et produit de l’hydrogène gazeux et du chlorure d’aluminium.
- Une autre méthode courante de synthèse du chlorure d’aluminium consiste à faire réagir l’oxyde d’aluminium avec l’acide chlorhydrique. Cette réaction produit du chlorure d’aluminium et de l’eau comme produits.
- La réaction de l’aluminium avec un mélange de chlore gazeux et de monoxyde de carbone est une autre méthode de synthèse du chlorure d’aluminium. Cette réaction se produit à haute température et produit du chlorure d’aluminium et du dioxyde de carbone.
Dans l’ensemble, la synthèse du chlorure d’aluminium nécessite une manipulation minutieuse et un contrôle des conditions de réaction pour garantir un processus sûr et efficace.
Utilisations du chlorure d’aluminium
Le chlorure d’aluminium a de nombreuses utilisations dans diverses industries en raison de ses propriétés uniques.
- Les réactions de chimie organique, notamment la production de polymères, de produits pharmaceutiques et de parfums, utilisent couramment le chlorure d’aluminium comme catalyseur.
- Le traitement de l’eau potable et des eaux usées pour éliminer les matières en suspension implique souvent l’utilisation de chlorure d’aluminium comme coagulant.
- La production d’aluminium et d’alliages bénéficie de l’utilisation de chlorure d’aluminium comme fondant, qui aide à éliminer les impuretés et à améliorer le processus de coulée.
- Dans l’industrie pétrochimique, le chlorure d’aluminium sert de catalyseur dans la production d’essence et d’autres hydrocarbures. De plus, il est utilisé comme déodorant et antisudorifique dans les produits de soins personnels.
- Certains médicaments en vente libre utilisent du chlorure d’aluminium, qui possède des propriétés astringentes, pour traiter les irritations cutanées mineures et arrêter les saignements. Le chlorure d’aluminium est également utilisé pour traiter l’hyperhidrose, une affection caractérisée par une transpiration excessive.
- L’industrie textile utilise le chlorure d’aluminium comme mordant pour aider à fixer les colorants sur les tissus, et il est également utilisé dans la production de caoutchouc synthétique.
Dans l’ensemble, le chlorure d’aluminium trouve des utilisations diverses et importantes dans de nombreuses industries, soulignant ainsi son importance dans le monde moderne.
Des questions:
Q : Qu’est-ce qui compare le mieux 1 mole de chlorure de sodium à 1 mole de chlorure d’aluminium ?
R : 1 mole de chlorure de sodium (NaCl) et 1 mole de chlorure d’aluminium (AlCl3) contiennent toutes deux 1 mole d’ions chlorure, mais le chlorure d’aluminium contient trois fois plus de cations que le chlorure de sodium.
Q : Le chlorure d’aluminium est-il aqueux ?
R : Le chlorure d’aluminium peut exister sous forme solide et aqueuse. Lorsqu’il est dissous dans l’eau, il forme une solution très acide en raison de l’hydrolyse du cation aluminium.
Q : Quelle est la formule correcte pour le chlorure d’aluminium ?
R : La formule correcte pour le chlorure d’aluminium est AlCl3. Cela indique que chaque molécule de chlorure d’aluminium contient un cation aluminium (Al3+) et trois anions chlorure (Cl-).
Q : Le chlorure d’aluminium est-il sans danger ?
R : Le chlorure d’aluminium peut être dangereux s’il n’est pas manipulé correctement. Il peut provoquer une irritation de la peau et des yeux, une irritation des voies respiratoires et digestives et peut être toxique en cas d’ingestion ou d’inhalation. Il doit être stocké et manipulé dans un endroit bien ventilé et avec un équipement de protection approprié.
Q : Combien d’ions chlorure y a-t-il dans 1,50 mole de chlorure d’aluminium ?
R : Puisque la formule du chlorure d’aluminium est AlCl3, chaque molécule contient trois ions chlorure. Par conséquent, 1,50 mole de chlorure d’aluminium contient 1,50 x 3 = 4,50 moles d’ions chlorure.
