L’acétophénone ou méthylphénylcétone est un composé organique aromatique de formule C8H8O. Il est utilisé dans la production de parfums et de résines, ainsi que comme solvant et intermédiaire dans les produits pharmaceutiques.
| Nom UICPA | 1-phényléthanone |
| Formule moléculaire | C8H8O |
| Numero CAS | 98-86-2 |
| Synonymes | Méthylphénylcétone, phénylméthylcétone, AP, acétylbenzène, benzoylméthyle, éthylphénylcétone, Hypnon |
| InChI | InChI=1S/C8H8O/c1-7(9)8-5-3-2-4-6-8/h2-6H,1H3 |
Structure de l’acétophénone
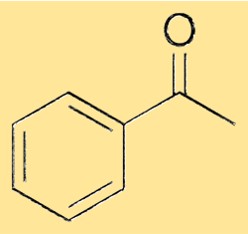
La structure de l’acétophénone est constituée d’un groupe phényle lié à un groupe carbonyle via une simple liaison. Le groupe carbonyle est constitué d’un atome de carbone doublement lié à un atome d’oxygène. Le groupe phényle est un cycle à six chaînons d’atomes de carbone auquel sont attachés cinq atomes d’hydrogène, et la sixième position est occupée par l’atome de carbone carbonyle. Cette structure confère à l’acétophénone ses propriétés caractéristiques et lui permet de servir de matière première polyvalente pour la synthèse d’une variété de produits chimiques.
Point de fusion de l’acétophénone
L’acétophénone a un point de fusion de -15,7 °C. Le point de fusion est la température à laquelle un solide se transforme en liquide à pression constante. L’acétophénone est un solide cristallin à température ambiante et a un point de fusion relativement bas par rapport à d’autres composés similaires. Le point de fusion d’un composé est déterminé par sa structure moléculaire et la force de ses forces intermoléculaires.
Spectre IR de l’acétophénone
Le spectre IR de l’acétophénone présente des pics caractéristiques à 1705 cm^-1, ce qui correspond au groupe carbonyle, et à 3030-3100 cm^-1, ce qui correspond à l’étirement du CH aromatique. Ces pics fournissent des informations importantes concernant les groupes fonctionnels présents dans la molécule.
Masse molaire de l’acétophénone :
L’acétophénone a une masse molaire de 120,15 g/mol. C’est un composé organique aromatique avec un groupe carbonyle attaché à un cycle phényle. La masse molaire est la somme des masses atomiques des atomes contenus dans une mole du composé. Dans le cas de l’acétophénone, elle possède 8 atomes de carbone, 8 atomes d’hydrogène et un atome d’oxygène, ce qui donne un total de 17 atomes dans une molécule. La masse molaire est une propriété importante d’un composé car elle est utilisée pour calculer la quantité de substance dans un échantillon donné, ce qui est nécessaire pour diverses applications en chimie et dans l’industrie.
Point d’ébullition de l’acétophénone
L’acétophénone a un point d’ébullition de 202 °C. Le point d’ébullition est la température à laquelle un liquide se transforme en gaz à pression constante. L’acétophénone est un composé organique volatil et a un point d’ébullition relativement élevé par rapport à d’autres composés similaires. Le point d’ébullition d’un composé est déterminé par la force de ses forces intermoléculaires, qui sont les forces qui maintiennent les molécules ensemble à l’état liquide ou solide. Dans le cas de l’acétophénone, elle possède un groupe carbonyle polaire qui peut former des liaisons hydrogène avec d’autres molécules d’acétophénone, ce qui renforce les forces intermoléculaires et augmente le point d’ébullition.
Densité de méthylphénylcétone g/ml
La méthylphénylcétone a une densité de 1,03 g/mL à température ambiante. La densité est la masse d’une substance par unité de volume. La méthylphénylcétone est un liquide à température ambiante et a une densité relativement élevée par rapport à d’autres composés similaires. La densité d’un composé est déterminée par son poids moléculaire et la densité de ses molécules dans un volume donné. Dans le cas de la méthylphénylcétone, elle a un poids moléculaire relativement élevé et une structure moléculaire relativement compacte, ce qui rend le regroupement de ses molécules plus efficace et augmente la densité.
Poids moléculaire du méthylphénylcétone
La méthylphénylcétone a un poids moléculaire de 120,15 g/mol. Le poids moléculaire est la somme des poids atomiques de tous les atomes d’une molécule. La méthylphénylcétone possède 8 atomes de carbone, 8 atomes d’hydrogène et un atome d’oxygène, ce qui donne un total de 17 atomes dans une molécule. Le poids moléculaire est une propriété importante d’un composé car il est utilisé pour calculer la quantité de substance dans un échantillon donné, ce qui est nécessaire pour diverses applications en chimie et dans l’industrie.
| Apparence | Liquide incolore à jaune pâle |
| Gravité spécifique | 1,028-1,031 à 25 °C |
| Couleur | Incolore à jaune pâle |
| Odeur | Doux, floral, miellé |
| Masse molaire | 120,15 g/mole |
| Densité | 1,03 g/mL à 25 °C |
| Point de fusion | -15,7 °C |
| Point d’ébullition | 202 °C |
| Point d’éclair | 78 °C |
| Solubilité dans l’eau | 3,3 g/L à 25 °C |
| Solubilité | Soluble dans l’alcool, l’éther, le chloroforme et le benzène |
| La pression de vapeur | 0,27 mmHg à 25 °C |
| Densité de vapeur | 4,15 (air = 1) |
| pKa | 10.01 |
| pH | Sans objet (la méthylphénylcétone n’est ni un acide ni une base) |
Sécurité et dangers de la méthylphénylcétone
La méthylphénylcétone peut être dangereuse si elle n’est pas manipulée correctement. Il peut provoquer une irritation de la peau, des yeux et du système respiratoire en cas de contact ou d’inhalation. L’exposition directe à des concentrations élevées de vapeurs de méthylphénylcétone peut provoquer des maux de tête, des étourdissements ou des nausées. L’ingestion de méthylphénylcétone peut provoquer une irritation gastro-intestinale, des vomissements ou de la diarrhée. La méthylphénylcétone est également inflammable et peut former des mélanges explosifs avec l’air. Il doit être stocké dans un endroit frais, sec et bien ventilé, à l’écart des sources d’ignition. Des équipements de protection individuelle, tels que des gants, des lunettes de sécurité et un respirateur, doivent être portés lors de la manipulation de la méthylphénylcétone.
| Symboles de danger | Xi : Irritant, F : Facilement inflammable |
| Description de la sécurité | S16 : Tenir à l’écart de sources d’ignition – Ne pas fumer, S26 : En cas de contact avec les yeux, rincer immédiatement et abondamment à l’eau et consulter un médecin, S36 : Porter un vêtement de protection adapté, S37 : Porter des gants adaptés, S39 : Porter un vêtement de protection approprié. protection du visage |
| Numéros d’identification de l’ONU | ONU 2319 |
| Code SH | 291439 |
| Classe de danger | 3 (Liquides inflammables) |
| Groupe d’emballage | III |
| Toxicité | La méthylphénylcétone est classée comme irritant oculaire de catégorie 3 et irritant cutané de catégorie 4. Il n’est pas considéré comme cancérigène ou mutagène. La DL50 orale (dose mortelle pour 50 % des sujets testés) chez le rat est d’environ 3 000 mg/kg. Il n’est pas considéré comme un risque environnemental important. |
Méthodes de synthèse de méthylphénylcétone
Diverses méthodes existent pour synthétiser la méthylphénylcétone.
Une méthode courante est l’acylation Friedel-Crafts du benzène avec du chlorure d’acétyle en présence d’un catalyseur acide de Lewis tel que le chlorure d’aluminium. Cette réaction produit de la méthylphénylcétone et du chlorure d’hydrogène comme sous-produits.
Une autre méthode est l’oxydation de l’éthylbenzène à l’aide d’air ou d’oxygène en présence d’un catalyseur métallique tel que le cobalt ou le manganèse. Cette réaction produit de la méthylphénylcétone et de l’acide acétique comme sous-produits.
On peut synthétiser la méthylphénylcétone en réduisant la phénylacétone à l’aide d’agents réducteurs tels que le borohydrure de sodium ou l’hydrure de lithium et d’aluminium. Cette réaction produit de la méthylphénylcétone et l’alcool correspondant comme sous-produits.
Une autre méthode implique la réaction du chlorure de benzoyle avec l’éthylbenzène en présence d’un catalyseur de chlorure d’aluminium pour produire de la méthylphénylcétone et du chlorure d’hydrogène comme sous-produits.
Utilisations de méthylphénylcétone
La méthylphénylcétone a plusieurs utilisations dans diverses industries.
- La méthylphénylcétone est largement utilisée comme solvant pour diverses résines, esters de cellulose et plastiques.
- L’industrie alimentaire utilise la méthylphénylcétone comme agent aromatisant, notamment pour les arômes de cerise et d’amande.
- L’industrie des parfums utilise la méthylphénylcétone comme matière première pour la production de parfums et autres produits parfumés.
- Divers produits chimiques tels que des produits pharmaceutiques, des produits agrochimiques et des colorants sont synthétisés à l’aide de méthylphénylcétone.
- La méthylphénylcétone sert d’intermédiaire dans la production de phénylacétone, précurseur de la synthèse des amphétamines.
- La coumarine, un parfum utilisé dans les savons et les détergents, est synthétisée à partir de méthylphénylcétone.
- Les réactifs de chimie organique utilisent la méthylphénylcétone comme réactif pour la synthèse de divers composés.
- La méthylphénylcétone sert de matière première pour la production d’autres produits chimiques tels que le styrène et le méthylstyrène.
Dans l’ensemble, la méthylphénylcétone a un large éventail d’applications dans diverses industries en raison de ses propriétés et utilisations polyvalentes.
Des questions:
Q : L’acétophénone est-elle polaire ?
R : Oui, l’acétophénone est polaire en raison de la présence d’un groupe carbonyle (C=O) et d’un cycle phényle, qui créent un moment dipolaire.
Q : Le benzaldéhyde ou l’acétophénone sont-ils plus polaires ?
R : Le benzaldéhyde est plus polaire que l’acétophénone car il a un moment dipolaire plus élevé en raison de la présence d’un groupe aldéhyde (CHO) en plus du cycle phényle.
Q : Spectre IR de l’acétophénone ?
R : Le spectre IR de l’acétophénone montre une bande d’absorption forte et large autour de 1 700 cm^-1, ce qui est caractéristique de la vibration d’étirement du carbonyle (C=O). Il présente également des pics autour de 3000-3100 cm^-1, qui correspondent aux vibrations d’étirement du CH aromatique.
Q : De l’acétophénone à l’acide benzoïque ?
R : L’acétophénone peut être convertie en acide benzoïque par oxydation à l’aide d’un agent oxydant tel que le permanganate de potassium ou l’acide chromique. Cette réaction entraîne le clivage de la liaison carbone-carbone adjacente au groupe carbonyle, suivi de l’oxydation de l’intermédiaire résultant pour produire de l’acide benzoïque.
Q : Du benzène à l’acétophénone ?
R : Le benzène peut être converti en acétophénone par acylation de Friedel-Crafts en utilisant du chlorure d’acétyle ou de l’anhydride acétique en présence d’un catalyseur acide de Lewis tel que le chlorure d’aluminium. Cette réaction entraîne la substitution d’un atome d’hydrogène du benzène par un groupe acétyle (-COCH3), suivie d’un réarrangement pour former de l’acétophénone.
