Le bicarbonate de lithium (LiHCO3) est un composé chimique utilisé dans diverses applications. Il possède des propriétés alcalines et est utilisé dans la recherche, dans les produits pharmaceutiques et comme traitement potentiel pour certaines conditions médicales.
| Nom UICPA | Bicarbonate de lithium |
| Formule moléculaire | LiHCO3 |
| Numero CAS | 5006-97-3 |
| Synonymes | Carbonate d’hydrogène de lithium, bicarbonate de Li |
| InChI | InChI=1S/CH2O3.Li/c2-1(3)4;/h(H2,2,3,4);/q;+1 |
Propriétés du bicarbonate de lithium
Formule de bicarbonate de lithium
L’hydrogénocarbonate de lithium a la formule chimique LiHCO3. Il se compose d’un cation lithium (Li), d’un anion hydrogénocarbonate (HCO3) et d’un atome d’hydrogène (H). La formule reflète la présence d’ions lithium et bicarbonate dans le composé.
Bicarbonate De Lithium Masse molaire
La masse molaire de l’hydrogénocarbonate de lithium (LiHCO3) est d’environ 68 grammes par mole (g/mol). Il est calculé en additionnant les masses atomiques de ses éléments constitutifs : lithium, hydrogène, carbone et oxygène.
Point d’ébullition du bicarbonate de lithium
L’hydrogénocarbonate de lithium n’a pas de point d’ébullition bien défini car il se décompose à des températures élevées. En chauffant, il perd du dioxyde de carbone (CO2) et de l’eau (H2O), se transformant en carbonate de lithium (Li2CO3).
Bicarbonate de lithium Point de fusion
L’hydrogénocarbonate de lithium a un point de fusion d’environ 250 degrés Celsius (482 degrés Fahrenheit). A cette température, il subit une transition de phase de l’état solide à l’état liquide.
Densité du bicarbonate de lithium g/mL
La densité de l’hydrogénocarbonate de lithium (LiHCO3) est d’environ 2,21 grammes par millilitre (g/mL). C’est un composé relativement dense en raison de la présence de lithium et d’autres éléments lourds.
Bicarbonate De Lithium Poids moléculaire
L’hydrogénocarbonate de lithium a un poids moléculaire d’environ 68 g/mol. Le poids moléculaire représente la somme des poids atomiques de tous les atomes d’une seule molécule du composé.
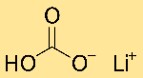
Structure du bicarbonate de lithium
L’hydrogénocarbonate de lithium a une structure cristalline. Il forme un réseau d’atomes de lithium, d’hydrogénocarbonate et d’hydrogène, disposés selon un motif répétitif. La structure est maintenue ensemble par des liaisons ioniques et covalentes.
Solubilité du bicarbonate de lithium
L’hydrogénocarbonate de lithium est peu soluble dans l’eau. Il se dissout dans une certaine mesure dans l’eau, donnant une solution légèrement alcaline. Cependant, sa solubilité est relativement faible par rapport aux autres composés du lithium.
| Apparence | Poudre cristalline blanche |
| Gravité spécifique | ~2,21 g/mL |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | ~68 g/mole |
| Densité | ~2,21 g/mL |
| Point de fusion | ~250°C (482°F) |
| Point d’ébullition | Se décompose |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Peu soluble, donnant une solution légèrement alcaline |
| Solubilité | Limité |
| La pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | Pas disponible |
| pH | Légèrement alcalin |
Sécurité et dangers du bicarbonate de lithium
L’hydrogénocarbonate de lithium présente certaines considérations de sécurité et certains dangers. Il est essentiel de manipuler le composé avec précaution pour minimiser les risques. Le contact direct avec la peau ou les yeux peut provoquer une irritation. L’inhalation de poussières ou de fumées doit être évitée, car cela pourrait entraîner une gêne respiratoire. Lorsqu’il est chauffé, il se décompose, libérant du dioxyde de carbone et de la vapeur d’eau, qui peuvent être potentiellement dangereux dans les espaces clos. De plus, il est crucial de stocker correctement l’hydrogénocarbonate de lithium, à l’écart des substances incompatibles. Une ventilation adéquate et un équipement de protection individuelle doivent être utilisés lorsque vous travaillez avec ce composé pour garantir un environnement sûr.
| Symboles de danger | Pas disponible |
| Description de la sécurité | Manipuler avec soin. Évitez l’inhalation, le contact avec la peau et les yeux. Conserver correctement. Utiliser dans des zones bien ventilées. |
| Numéros d’identification de l’ONU | Pas disponible |
| Code SH | Pas disponible |
| Classe de danger | Pas disponible |
| Groupe d’emballage | Pas disponible |
| Toxicité | Faible toxicité ; manipuler avec prudence. |
Méthodes de synthèse du bicarbonate de lithium
Diverses méthodes permettent la synthèse de l’hydrogénocarbonate de lithium.
Une approche courante consiste à faire réagir l’hydroxyde de lithium (LiOH) avec du dioxyde de carbone (CO2). La réaction a lieu dans une solution aqueuse où l’hydroxyde de lithium se dissocie en ions lithium et hydroxyde. Simultanément, le dioxyde de carbone se dissout dans l’eau, formant de l’acide carbonique (H2CO3) . Les ions lithium réagissent ensuite avec l’acide carbonique pour produire de l’hydrogénocarbonate de lithium (LiHCO3) et de l’eau (H2O). L’équation chimique de cette réaction est :
LiOH + CO2 → LiHCO3 + H2O
Une autre méthode consiste à traiter le carbonate de lithium (Li2CO3) avec du dioxyde de carbone dans un système fermé, produisant du bicarbonate de lithium. L’équation chimique de cette réaction est :
Li2CO3 + CO2 → 2LiHCO3
Ces méthodes de synthèse sont importantes pour la production d’hydrogénocarbonate de lithium en laboratoire et pour des applications industrielles. Il est crucial de suivre les protocoles de sécurité et de garantir un équipement et des conditions appropriés pendant le processus de synthèse.
Utilisations du bicarbonate de lithium
L’hydrogénocarbonate de lithium trouve de nombreuses applications en raison de ses propriétés uniques. Voici quelques-unes de ses principales utilisations :
- Recherche et laboratoire : il sert de réactif précieux dans diverses expériences chimiques et de recherche, permettant aux scientifiques d’étudier les réactions et les propriétés chimiques.
- Traitement médical potentiel : Des études sont en cours sur son rôle potentiel en tant que traitement de maladies telles que la carence en lithium et certains troubles rénaux, ainsi qu’en tant qu’agent alcalinisant.
- Applications environnementales : Il peut contribuer à l’élimination du dioxyde de carbone des processus industriels et a des applications potentielles dans l’atténuation des émissions de gaz à effet de serre.
- Agent alcalinisant : Dans des processus industriels spécifiques, il agit comme agent alcalinisant pour contrôler l’acidité et réguler les niveaux de pH.
- Industrie pharmaceutique : Les formulations pharmaceutiques utilisent du carbonate acide de lithium principalement dans les médicaments contre les troubles de l’humeur comme le trouble bipolaire.
- Production de batteries au lithium : les chercheurs et les milieux expérimentaux explorent l’utilisation de l’hydrogénocarbonate de lithium dans les batteries avancées à base de lithium pour améliorer les performances des batteries.
- Traitement de l’eau : Les processus de traitement de l’eau utilisent du bicarbonate de lithium pour ajuster le pH des sources d’eau.
- Agriculture : L’hydrogénocarbonate de lithium trouve une utilisation limitée dans les pratiques agricoles, où les agriculteurs l’utilisent pour traiter des conditions spécifiques du sol et améliorer la croissance des plantes.
Malgré ces applications, il est crucial de manipuler l’hydrogénocarbonate de lithium avec précaution et de suivre les consignes de sécurité, compte tenu de ses dangers potentiels et de sa réactivité. À mesure que la recherche et les progrès technologiques se poursuivent, de nouvelles utilisations de l’hydrogénocarbonate de lithium pourraient émerger, renforçant encore son importance dans divers domaines.
Des questions:
Q : Quelle est la formule chimique du bicarbonate de lithium ?
R : La formule chimique de l’hydrogénocarbonate de lithium est LiHCO3.
Q : Le bicarbonate de lithium peut-il entraîner une faible teneur en vitamine D ?
R : Il n’existe aucune preuve suggérant que l’hydrogénocarbonate de lithium entraîne de faibles niveaux de vitamine D.
Q : Qu’est-ce qui fonctionne le mieux : le carbonate de lithium ou le bicarbonate de lithium ?
R : L’efficacité du carbonate de lithium ou du bicarbonate de lithium dépend de leurs applications spécifiques et de leur utilisation prévue.
Q : Le bicarbonate de lithium interagit-il avec l’extrait de valériane ?
R : Il n’existe aucune interaction connue entre l’hydrogénocarbonate de lithium et l’extrait de valériane, mais il est essentiel de consulter un professionnel de la santé.
Q : Qu’est-ce que le bicarbonate de lithium ?
R : L’hydrogénocarbonate de lithium est un composé chimique aux propriétés alcalines, utilisé dans diverses applications, notamment la recherche et les produits pharmaceutiques.
Q : Le bicarbonate de lithium et le carbonate de lithium peuvent-ils être chauffés dans l’eau ?
R : L’hydrogénocarbonate de lithium et le carbonate de lithium peuvent être chauffés dans l’eau, mais ils se décomposeront pour former d’autres composés.
Q : Quelle est la perte de poids lorsque 3,45 g de LiHCO3 sont décomposés ?
R : La perte de poids lorsque 3,45 g de LiHCO3 sont décomposés dépendra de la réaction spécifique et des produits formés.
Q : Le LiHCO3 est-il un électrolyte puissant ?
R : Non, l’hydrogénocarbonate de lithium (LiHCO3) est un électrolyte faible.
Q : Quel sel serait produit par la réaction du H2SO4 avec LiHCO3 ?
R : La réaction entre H2SO4 et LiHCO3 produira du sulfate de lithium (Li2SO4), du dioxyde de carbone (CO2) et de l’eau (H2O).
Q : Le LiHCO3 est-il un acide ou une base ?
R : L’hydrogénocarbonate de lithium (LiHCO3) agit comme une base en raison de ses propriétés alcalines.
Q : La N-méthyléthanamine réagit-elle avec le LiHCO3 ?
R : La réactivité de la N-méthyléthanamine avec LiHCO3 dépendra des conditions de réaction spécifiques et des produits souhaités.
