Le nitrate de magnésium est un composé cristallin blanc de formule chimique Mg(NO3)2. Il est utilisé dans la production d’engrais, d’explosifs et de produits pyrotechniques en raison de sa haute réactivité et de ses propriétés oxydantes.
| Nom UICPA | Dinitrate de magnésium |
| Formule moléculaire | Mg(NO3)2 |
| Numero CAS | 10377-60-3 |
| Synonymes | Acide nitrique, sel de magnésium ; ONU 1474 ; Nitrate de magnésium (II); Sel de magnésium d’acide nitrique (2+) |
| InChI | InChI=1S/Mg.2NO3/c;22-1(3)4/q+2;2-1 |
Formule de nitrate de magnésium
La formule chimique du nitrate de magnésium est Mg(NO3)2, ce qui indique que le composé contient un cation magnésium (Mg²⁺) et deux anions nitrate (NO₃⁻). Cette formule est utilisée pour représenter la stœchiométrie du composé dans des équations chimiques et est également utilisée pour déterminer le poids moléculaire et d’autres propriétés du nitrate de magnésium.
Masse molaire du nitrate de magnésium
La masse molaire du nitrate de magnésium, qui est représentée par la formule chimique Mg(NO3)2, est d’environ 148,31 g/mol. Cette valeur peut être calculée en additionnant les masses atomiques de magnésium (24,31 g/mol), de deux atomes d’azote (28,02 g/mol chacun) et de six atomes d’oxygène (16,00 g/mol chacun) présents dans le composé. La connaissance de la masse molaire est cruciale pour déterminer la quantité de nitrate de magnésium nécessaire aux réactions chimiques ou à la préparation de solutions.
Point d’ébullition du nitrate de magnésium
Le Mg(NO3)2 a un point d’ébullition relativement élevé d’environ 330 °C (626 °F) à pression atmosphérique. Cette valeur peut varier légèrement en fonction de la pureté et de la concentration du composé. Le point d’ébullition du Mg(NO3)2 est important dans les processus industriels impliquant la production d’engrais, d’explosifs et de pièces pyrotechniques, ainsi que dans les expériences en laboratoire.
Point de fusion du nitrate de magnésium
Le point de fusion du Mg(NO3)2, qui est la température à laquelle le composé solide passe à l’état liquide, est d’environ 89 °C (192 °F) pour la forme anhydre et 95 °C (203 °F) pour la forme anhydre. forme hexahydratée. La forme hexahydratée du Mg(NO3)2 est plus couramment utilisée en raison de sa stabilité et de sa facilité de manipulation. Le point de fusion est une propriété physique essentielle utilisée pour déterminer la pureté du Mg(NO3)2 ainsi que dans divers procédés industriels.
Densité du nitrate de magnésium g/ml
La densité de Mg(NO3)2 varie selon la forme du composé. La forme anhydre a une densité d’environ 2,3 g/cm³, tandis que la forme hexahydratée a une densité d’environ 1,46 g/cm³. La densité du Mg(NO3)2 est un facteur crucial pour déterminer le volume du composé requis dans les réactions chimiques, ainsi que pour son stockage et son transport.
Poids moléculaire du nitrate de magnésium
Le poids moléculaire du Mg(NO3)2, qui est la somme des poids atomiques de tous les éléments du composé, est d’environ 148,31 g/mol. Cette valeur est importante dans divers calculs chimiques, notamment pour déterminer la quantité de Mg(NO3)2 requise dans les réactions ou dans la préparation de solutions.
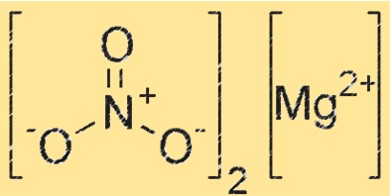
Structure du nitrate de magnésium
Mg(NO3)2 a une structure cristalline qui appartient au système cristallin orthorhombique. Le composé est constitué de cations magnésium (Mg²⁺) et d’anions nitrate (NO₃⁻), chaque cation magnésium étant entouré de six anions nitrate dans un arrangement octaédrique. La structure cristalline du Mg(NO3)2 joue un rôle crucial dans sa réactivité et ses propriétés.
| Apparence | Solide cristallin blanc |
| Gravité spécifique | 2,3 (anhydre), 1,46 (hexahydraté) |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 148,31 g/mole |
| Densité | 2,3 g/cm³ (anhydre), 1,46 g/cm³ (hexahydraté) |
| Point de fusion | 89 °C (anhydre), 95 °C (hexahydraté) |
| Point d’ébullition | 330 °C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | 234 g/L (anhydre), 156 g/L (hexahydraté) à 20 °C |
| Solubilité | Soluble dans l’eau, l’éthanol, le méthanol |
| Pression de vapeur | 0,000009 mmHg à 20 °C |
| Densité de vapeur | N’est pas applicable |
| pKa | 1.8 |
| pH | 4,5-6,0 (solution à 5 %) |
Sécurité et dangers du nitrate de magnésium
Le Mg(NO3)2 peut présenter divers risques pour la sécurité s’il n’est pas manipulé correctement. Il peut provoquer une irritation et des brûlures de la peau, des yeux et des voies respiratoires par contact ou par inhalation. Le composé est également un agent oxydant puissant et peut réagir violemment avec les matières organiques, notamment les substances inflammables et combustibles. L’inhalation de poussières de Mg(NO3)2 peut provoquer une irritation respiratoire et même des lésions pulmonaires. Stockez et manipulez le Mg(NO3)2 dans un endroit frais, sec et bien ventilé, à l’écart de toute source d’inflammation. Lors de la manipulation de ce composé, utilisez un équipement de protection individuelle approprié tel que des gants et des lunettes de sécurité.
| Symboles de danger | Agent d’oxydation |
| Description de la sécurité | Évitez tout contact avec des matériaux combustibles. Portez un équipement de protection individuelle. Tenir à l’écart des sources d’ignition. |
| Identifiants ONU | ONU 1474 |
| Code SH | 283429 |
| Classe de danger | 5.1 (Agents comburants) |
| Groupe d’emballage | II |
| Toxicité | DL50 (orale, rat) : 3 500 mg/kg ; DL50 (cutanée, lapin) : > 2000 mg/kg. Le nitrate de magnésium n’est pas considéré comme cancérigène, mutagène ou tératogène. |
Méthodes de synthèse du nitrate de magnésium
On peut synthétiser le nitrate de magnésium (Mg(NO3)2) par plusieurs méthodes, notamment la réaction de l’oxyde de magnésium ou de l’hydroxyde de magnésium avec de l’acide nitrique.
Une méthode consiste à ajouter de l’oxyde de magnésium à une solution d’ acide nitrique dans un flacon, puis à chauffer doucement le mélange jusqu’à ce qu’il se dissolve. Pour obtenir les cristaux de Mg(NO3)2, filtrer la solution pour éliminer les impuretés et évaporer le solvant.
Une autre méthode de synthèse consiste à faire réagir le magnésium métallique avec de l’acide nitrique . Ajoutez des bandes de magnésium à l’acide et laissez la réaction se poursuivre jusqu’à ce que tout le métal se dissolve. Évaporez ensuite la solution obtenue pour obtenir les cristaux de Mg(NO3)2.
Dissoudre le carbonate de magnésium dans l’acide nitrique pour former du Mg(NO3)2 et du dioxyde de carbone. Filtrez la solution obtenue et évaporez-la pour obtenir des cristaux de Mg(NO3)2.
Une autre méthode consiste à faire réagir de l’hydroxyde de magnésium avec de l’acide nitrique pour produire du Mg(NO3)2 et de l’eau. La solution obtenue est ensuite purifiée par filtration et évaporation pour obtenir les cristaux de Mg(NO3)2.
Utilisations du nitrate de magnésium
Le nitrate de magnésium a de nombreuses utilisations dans diverses industries et applications. Certaines des principales utilisations du Mg(NO3)2 sont :
- Agriculture : Utilisé comme engrais, en particulier pour les cultures qui nécessitent des niveaux élevés de magnésium, comme les tomates, les poivrons et les agrumes. Il contribue à améliorer la croissance des plantes et améliore la qualité et le rendement des cultures.
- Produits pyrotechniques : Utilisé comme comburant dans les feux d’artifice et autres applications pyrotechniques, car il peut produire des flammes vives et intenses et aider à contrôler le taux de combustion.
- Production de verre : utilisé comme flux dans la production de verre pour abaisser le point de fusion du verre et améliorer ses propriétés d’écoulement.
- Synthèse chimique : utilisé comme réactif dans diverses réactions de synthèse chimique, telles que la production d’autres composés de magnésium, de catalyseurs et de produits pharmaceutiques.
- Conservation : Utilisé comme conservateur alimentaire pour inhiber la croissance des bactéries et autres micro-organismes.
- Applications industrielles : Utilisé dans la production d’oxyde de magnésium et d’hydroxyde de magnésium, qui sont utilisés comme ignifugeants, dans le traitement des eaux usées et comme agent neutralisant dans les sols acides.
- Recherche en laboratoire : Utilisé dans diverses expériences et recherches en laboratoire, telles que la préparation de solutions étalons et le test de procédures analytiques.
Des questions:
Q : Le Mg(NO3)2 est-il soluble ?
R : Oui, le nitrate de magnésium est très soluble dans l’eau.
Q : Quelle est la formule du nitrate de magnésium ?
R : La formule du nitrate de magnésium est Mg(NO3)2.
Q : Quelle est la masse molaire de Mg(NO3)2 ?
R : La masse molaire de Mg(NO3)2 est de 148,31 g/mol.
Q : Quel est le poids de formule de Mg(NO3)2 ?
R : Le poids de la formule de Mg(NO3)2 est de 148,31 g/mol.
Q : Quel est le nom systématique de Mg(NO3)2 ?
R : Le nom systématique de Mg(NO3)2 est dinitrate de magnésium.
Q : Quelle est la concentration d’ions nitrate dans une solution de Mg(NO3)2 à 0,125 M ?
R : La concentration d’ions nitrate dans une solution de Mg(NO3)2 à 0,125 M est de 0,25 M, car il y a deux ions nitrate pour chaque ion magnésium.
Q : Quelle est la masse de formule de Mg(NO3)2 ?
R : La masse de formule de Mg(NO3)2 est de 148,31 g/mol.
