Le nitrate de calcium est un composé chimique de formule Ca(NO3)2. C’est un solide incolore et inodore très soluble dans l’eau. Le nitrate de calcium est couramment utilisé comme engrais et dans le traitement des eaux usées. Il est également utilisé dans la production de béton, comme composant d’explosifs et dans la fabrication de divers autres produits chimiques.
| Nom UICPA | Dinitrate de calcium |
| Formule moléculaire | Ca(NO3)2 |
| Numero CAS | 10124-37-5 |
| Synonymes | Nitrate de calcium tétrahydraté, sel de calcium de l’acide nitrique, nitrocalcite, salpêtre norvégien, salpêtre de chaux, Norgessalpeter |
| InChI | InChI=1S/Ca.2NO3/c;22-1(3)4/q+2;2-1 |
Formule de nitrate de calcium
La formule du nitrate de calcium est Ca(NO3)2. Cela signifie que chaque unité de nitrate de calcium contient un ion calcium (Ca²⁺) et deux ions nitrate (NO3⁻). La formule du nitrate de calcium est souvent utilisée pour déterminer la masse molaire et d’autres propriétés du composé.
Nitrate De Calcium Masse molaire
Le nitrate de calcium a une masse molaire de 164,088 g/mol. C’est un sel composé d’ions Ca+2 et NO3-, de formule Ca(NO3)2. La masse molaire d’un composé est la masse en grammes d’une mole de ce composé, qui est égale à son poids de formule. Dans le cas de Ca(NO3)2, le poids de la formule est la somme des poids atomiques de tous les atomes du composé.
Point d’ébullition du nitrate de calcium
Le Ca(NO3)2 a un point d’ébullition relativement élevé de 132 degrés Celsius. Cela signifie qu’il faut une quantité importante d’énergie pour convertir le composé solide en gaz. Le point d’ébullition élevé du Ca(NO3)2 est dû à sa nature ionique, qui entraîne de fortes interactions électrostatiques entre les ions Ca+2 et NO3-.
Nitrate de Calcium Point de fusion
Le point de fusion du Ca(NO3)2 est de 561 degrés Celsius. Ceci est relativement élevé pour un sel et reflète une fois de plus les fortes interactions ioniques entre les ions Ca+2 et NO3-. Le point de fusion du Ca(NO3)2 en fait un composé utile pour les applications à haute température, comme dans la fabrication d’engrais ou d’explosifs.
Densité du nitrate de calcium g/ml
La densité du Ca(NO3)2 varie en fonction de sa forme. Par exemple, la densité du Ca(NO3)2 anhydre est d’environ 2,5 g/cm³, tandis que la densité du tétrahydrate (Ca(NO3)2.4H2O) est d’environ 1,82 g/cm³. Ces valeurs font du Ca(NO3)2 un composé relativement dense par rapport à de nombreux autres sels.
Nitrate De Calcium Poids moléculaire
Le poids moléculaire du Ca(NO3)2 est de 164,088 g/mol. Cette valeur est la somme des poids atomiques de tous les atomes du composé, qui comprend deux atomes d’azote, six atomes d’oxygène et un atome de calcium.
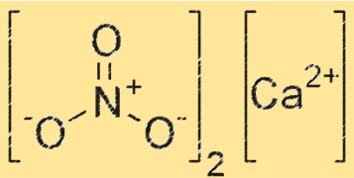
Structure du nitrate de calcium
Ca(NO3)2 a une structure ionique, avec l’ion calcium (Ca²⁺) entouré de six atomes d’oxygène dans un arrangement octaédrique. L’ion NO3- est également présent dans le réseau cristallin, chaque atome d’oxygène de l’ion NO3- formant une liaison de coordination avec l’ion Ca+2. La structure du Ca(NO3)2 est similaire à celle d’autres composés ioniques, comme le chlorure de sodium.
| Apparence | Cristaux ou poudre blancs |
| Gravité spécifique | 2,5 (anhydre) ; 1,82 (tétrahydraté) |
| Couleur | Incolore (anhydre); Blanc (tétrahydraté) |
| Odeur | Inodore |
| Masse molaire | 164,088 g/mole |
| Densité | 2,5 g/cm³ (anhydre) ; 1,82 g/cm³ (tétrahydraté) |
| Point de fusion | 561 °C (anhydre) ; 45 °C (tétrahydraté) |
| Point d’ébullition | 132 °C (se décompose) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | 121,2 g/100 ml (0 °C) ; 126,7 g/100 ml (20 °C) ; 179,6 g/100 ml (100 °C) |
| Solubilité | Soluble dans l’eau, l’éthanol, le méthanol |
| La pression de vapeur | Négligeable (anhydre) |
| Densité de vapeur | N’est pas applicable |
| pKa | N’est pas applicable |
| pH | 4,5-7,5 (solution à 10 %) |
Sécurité et dangers du nitrate de calcium
Le nitrate de calcium (Ca(NO3)2) peut présenter plusieurs dangers s’il n’est pas manipulé correctement. C’est un agent oxydant puissant qui peut provoquer un incendie ou une explosion s’il entre en contact avec des matériaux combustibles. Le composé peut également provoquer une irritation de la peau et des yeux au contact, et l’inhalation de poussière peut provoquer une irritation des voies respiratoires. Le Ca(NO3)2 doit être stocké dans un endroit frais et sec, loin des sources de chaleur et ne doit pas être mélangé avec d’autres produits chimiques sans précautions appropriées. Des équipements de protection individuelle tels que des gants et des lunettes de protection doivent être portés lors de la manipulation du Ca(NO3)2 pour éviter tout contact avec la peau ou les yeux. En cas d’ingestion accidentelle, des soins médicaux doivent être immédiatement recherchés.
| Symboles de danger | Agent oxydant (GHS05), Irritant (GHS07) |
| Description de la sécurité | S22 : Ne pas respirer les poussières/fumées/gaz/brouillards/vapeurs/aérosols. S26 : En cas de contact avec les yeux, rincer immédiatement et abondamment à l’eau et consulter un médecin. S36/37/39 : Porter des vêtements de protection appropriés, des gants et un équipement de protection des yeux/du visage. |
| Identifiants ONU | UN1454 (Nitrate de calcium anhydre), UN1455 (Nitrate de calcium tétrahydraté) |
| Code SH | 283429 |
| Classe de danger | 5.1 (Agents comburants) |
| Groupe d’emballage | III |
| Toxicité | Orale (DL50) : 3 420 mg/kg (rat) ; Cutané (DL50) : > 5 000 mg/kg (lapin) ; Inhalation (CL50) : >4,8 mg/l/4h (rat) |
Méthodes de synthèse du nitrate de calcium
Il existe diverses méthodes pour synthétiser le Ca(NO3)2 en fonction de l’application spécifique et de la pureté souhaitée.
Une méthode courante consiste à faire réagir du carbonate de calcium avec de l’acide nitrique pour produire du Ca(NO3)2 et du dioxyde de carbone :
CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O
Une autre méthode consiste à faire réagir de l’hydroxyde de calcium avec de l’acide nitrique :
Ca(OH)2 + 2HNO3 → Ca(NO3)2 + 2H2O
La réaction entre l’acide nitrique et l’oxyde de calcium donne Ca(NO3)2 :
CaO + 2HNO3 → Ca(NO3)2 + H2O
Le Ca(NO3)2 résultant peut être purifié davantage par recristallisation ou en ajoutant une petite quantité d’acide sulfurique pour éliminer les impuretés telles que le fer et l’aluminium.
Les fabricants peuvent produire du Ca(NO3)2 en faisant réagir du calcium métallique avec de l’acide nitrique ou en faisant réagir de l’hydroxyde de calcium avec du nitrate d’ammonium. Cependant, ils utilisent ces méthodes moins couramment en raison du coût plus élevé ou des problèmes de sécurité associés aux métaux réactifs ou au nitrate d’ammonium.
Utilisations du nitrate de calcium
- Utilisé comme engrais en agriculture pour fournir aux plantes des nutriments en calcium et en azote pour leur croissance.
- Utilisé comme composant dans plusieurs types de béton et de ciment pour améliorer leur résistance et leur durabilité.
- Utilisé comme additif dans la production de produits chimiques de traitement des eaux usées pour aider à éliminer les composés phosphorés et azotés de l’eau.
- Utilisé dans la production de plusieurs types d’explosifs et de feux d’artifice en raison de ses propriétés oxydantes.
- Utilisé comme source de calcium et d’azote dans la production de divers produits chimiques tels que le nylon et d’autres fibres synthétiques.
- Utilisé comme inhibiteur de corrosion pour les métaux tels que l’aluminium et l’acier dans les applications industrielles.
- Utilisé dans la conservation des viandes et comme additif alimentaire pour améliorer la qualité de certains produits alimentaires.
- Utilisé dans la production de bombes fumigènes et de fusées éclairantes pour des applications militaires et civiles.
- Utilisé dans la fabrication de certains engrais. Également utilisé en combinaison avec d’autres composés pour fournir un apport équilibré en nutriments aux cultures.
- Utilisé comme composant dans certains engrais spécialisés pour aquariums pour fournir des nutriments essentiels aux plantes aquatiques.
Des questions:
Q : Quel est le nom de Ca(NO3)2 ?
R : Le nom de Ca(NO3)2 est nitrate de calcium.
Q : Le Ca(NO3)2 est-il soluble dans l’eau ?
R : Oui, le Ca(NO3)2 est hautement soluble dans l’eau. À température ambiante, 100 grammes d’eau peuvent dissoudre jusqu’à 121 grammes de nitrate de calcium.
Q : Où acheter du nitrate de calcium ?
R : Le Ca(NO3)2 peut être acheté auprès de divers fournisseurs de produits chimiques, en ligne et en magasin. Certains endroits courants pour acheter du Ca(NO3)2 comprennent les entreprises de fournitures scientifiques, les magasins de fournitures agricoles et les centres de jardinage et de maison. Il est important de s’assurer que le fournisseur est réputé et que le produit est de haute qualité et adapté à l’application prévue.
