L’acide oxalique est un composé organique incolore et inodore que l’on retrouve dans de nombreux légumes et fruits. Il est utilisé dans divers procédés industriels tels que le nettoyage et le polissage des métaux. Il peut également être nocif s’il est ingéré en grande quantité.
| Nom UICPA | Acide éthanédioïque |
| Formule moléculaire | C2H2O4 |
| Numero CAS | 144-62-7 |
| Synonymes | Acide éthanedioïque, acide de sucre, acide oxirique, eau de Javel pour bois, acide d’oseille, acide C2dicarboxylique, etc. |
| InChI | InChI=1S/C2H2O4/c3-1(4)2(5)6/h(H,3,4)(H,5,6) |
Propriétés de l’acide oxalique
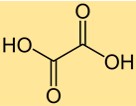
Formule d’acide oxalique
La formule chimique de l’acide oxalique est C2H2O4. Il se compose de deux atomes de carbone, de deux atomes d’oxygène et de quatre atomes d’hydrogène. La formule de l’acide oxalique est importante dans de nombreux calculs chimiques, tels que la détermination du poids moléculaire ou du nombre de moles d’acide oxalique dans un échantillon. La formule donne également des informations sur le rapport des atomes présents dans la molécule.
Masse molaire de Acide Oxalique
La masse molaire de l’acide éthanedioïque est de 90,03 g/mol. Ceci est calculé en additionnant les masses atomiques de chaque élément présent dans la molécule (2 atomes de carbone, 2 atomes d’oxygène et 4 atomes d’hydrogène). La masse molaire de l’acide éthanedioïque est importante dans de nombreux calculs chimiques, tels que la détermination de la quantité d’acide éthanedioïque nécessaire pour une réaction spécifique ou la concentration d’une solution d’acide éthanedioïque.
Point d’ébullition de l’acide oxalique
Le point d’ébullition de l’acide éthanedioïque est de 365 °C. À cette température, la phase liquide de l’acide éthanedioïque se transforme en phase vapeur et devient un gaz. Le point d’ébullition de l’acide éthanedioïque est influencé par divers facteurs tels que la pression, la pureté et la présence d’impuretés. L’acide oxalique est relativement stable à haute température, mais une exposition prolongée à la chaleur peut provoquer sa décomposition et produire du dioxyde de carbone et de l’eau.
Point de fusion de l’acide oxalique
Le point de fusion de l’acide éthanedioïque est de 189 à 191 °C. C’est la température à laquelle l’acide éthanedioïque solide commence à se liquéfier et à devenir liquide. Le point de fusion de l’acide éthanedioïque peut être affecté par divers facteurs, tels que la pureté, la pression et la structure cristalline. Le point de fusion est une propriété physique importante de l’acide éthanedioïque, car il aide à déterminer son aptitude à diverses applications.
Densité de l’acide oxalique g/ml
La densité de l’acide éthanedioïque est de 1,90 g/ml. Cela signifie qu’un millilitre d’acide éthanedioïque pèse 1,90 gramme. La densité de l’acide éthanedioïque peut varier en fonction de la température, de la pression et de la concentration de la solution. La densité de l’acide éthanedioïque est une propriété importante utilisée dans de nombreux processus chimiques et industriels, tels que la détermination de la quantité d’acide éthanedioïque nécessaire à une réaction ou le calcul du volume d’une solution.
Poids moléculaire de l’acide oxalique
Le poids moléculaire de l’acide éthanedioïque est de 90,03 g/mol. C’est la somme des poids atomiques de tous les atomes de la molécule. Le poids moléculaire de l’acide éthanedioïque est utilisé dans divers calculs chimiques, tels que la détermination du nombre de moles d’acide éthanedioïque dans un échantillon donné ou la concentration d’une solution d’acide éthanedioïque.
Structure de l’acide oxalique
L’acide oxalique a une structure d’acide di-carboxylique, avec deux groupes carboxyle (-COOH) attachés à un atome de carbone central. La molécule a une structure planaire, avec les deux groupes carboxyle orientés perpendiculairement. La structure de l’acide oxalique en fait un acide organique fort capable de donner deux protons dans une solution.
| Apparence | Poudre cristalline blanche |
| Gravité spécifique | 1,90 g/mL à 20 °C |
| Couleur | Incolore |
| Odeur | Inodore |
| Masse molaire | 90,03 g/mole |
| Densité | 1,90 g/mL à 20 °C |
| Point de fusion | 189-191 °C |
| Point d’ébullition | 365 °C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | 90 g/L à 20 °C |
| Solubilité | Soluble dans l’eau, l’alcool, l’éther et le glycérol |
| Pression de vapeur | 0,0001 mmHg à 25°C |
| Densité de vapeur | 3,3 (air=1) |
| pKa | pKa1=1,25, pKa2=4,14 |
| pH | 1,2 (solution 0,1M) |
Sécurité et dangers de l’acide oxalique
L’acide oxalique est une substance dangereuse qui peut être nocive si elle n’est pas manipulée correctement. Il peut être corrosif pour la peau, les yeux et le système respiratoire et provoquer des irritations ou des brûlures au contact. L’inhalation de poussières ou de vapeurs d’acide éthanedioïque peut également provoquer une irritation respiratoire et des lésions pulmonaires. Lors de la manipulation de l’acide éthanedioïque, il est important de porter un équipement de protection individuelle approprié, tel que des gants, des lunettes et un respirateur. De plus, il doit être stocké dans un endroit frais et sec, à l’écart des sources de chaleur et d’ignition. L’élimination de l’acide éthanedioïque doit être effectuée conformément aux réglementations locales.
| Symboles de danger | T, C |
| Description de la sécurité | Eviter le contact avec la peau et les yeux. Porter des vêtements de protection appropriés, des gants et une protection des yeux/du visage. En cas de contact avec les yeux, rincer immédiatement et abondamment à l’eau et consulter un médecin. En cas d’accident ou de malaise, consulter immédiatement un médecin (si possible lui montrer l’étiquette). |
| Identifiants ONU | UN3261 |
| Code SH | 291711 |
| Classe de danger | 8 |
| Groupe d’emballage | III |
| Toxicité | LD50 orale : 750 mg/kg (rat), DL50 cutanée : 1000 mg/kg (lapin), CL50 par inhalation : 1100 ppm/8h (rat) |
Méthodes de synthèse de l’acide oxalique
Il existe plusieurs méthodes de synthèse de l’acide oxalique (acide éthanedioïque), notamment l’oxydation des glucides, l’oxydation de l’éthylène glycol et la réaction du monoxyde de carbone avec l’hydroxyde de sodium .
L’une des méthodes les plus courantes consiste à oxyder les glucides à l’aide d’acide nitrique. L’hydrolyse des glucides produit des monosaccharides, que nous oxydons ensuite à l’aide d’acide nitrique et d’un catalyseur tel que le pentoxyde de vanadium. Après avoir traité le mélange obtenu avec du carbonate de calcium, nous le traitons avec de l’acide sulfurique pour libérer de l’acide éthanedioïque.
Une autre méthode de synthèse de l’acide éthanedioïque est l’oxydation de l’éthylène glycol à l’aide d’acide nitrique et d’un catalyseur tel que le platine ou le palladium. Nous oxydons l’éthylène glycol en acide glycolique, puis l’oxydons davantage en acide éthanedioïque à l’aide d’acide nitrique et d’un catalyseur. Nous traitons ensuite le mélange obtenu avec du carbonate de calcium et de l’acide sulfurique pour libérer de l’acide éthanedioïque.
Une troisième méthode de synthèse de l’acide éthanedioïque implique la réaction du monoxyde de carbone avec l’hydroxyde de sodium en présence d’un catalyseur tel que le nickel ou le cobalt. La réaction du monoxyde de carbone avec l’hydroxyde de sodium produit du formiate de sodium, que nous réagissons ensuite avec l’hydroxyde de sodium pour produire de l’oxalate de sodium. Le traitement de l’oxalate de sodium avec de l’acide sulfurique libère de l’acide éthanedioïque.
Utilisations de l’acide oxalique
L’acide oxalique a de nombreuses utilisations différentes dans diverses industries en raison de ses propriétés chimiques uniques. Voici quelques utilisations courantes de l’acide éthanedioïque :
- Élimination de la rouille : Couramment utilisé comme antirouille pour les surfaces métalliques, notamment le fer, l’acier et le cuivre.
- Agent de blanchiment : Utilisé dans l’industrie textile pour blanchir les tissus et les fibres.
- Travail du bois : utilisé pour éliminer les taches du bois, telles que les taches d’eau ou les taches causées par le fer ou d’autres métaux.
- Agent nettoyant : Utilisé comme agent nettoyant pour diverses surfaces, notamment les accessoires de salle de bain et de cuisine, les comptoirs et les sols.
- Agent chélateur : Également utilisé comme agent chélateur dans divers processus industriels, notamment la production de céramiques et de produits pharmaceutiques.
- Agent de gravure : utilisé comme agent de gravure dans l’industrie électronique pour éliminer les oxydes métalliques et les impuretés des surfaces des semi-conducteurs.
- Photographie : Utilisé en photographie comme agent de développement pour certains types de films photographiques.
- Utilisations médicales : Utilisé dans certains traitements médicaux, notamment l’élimination des dépôts de calcium du corps et le traitement des infections des voies urinaires.
Des questions:
Q : Où puis-je acheter de l’acide oxalique près de chez moi ?
R : L’acide oxalique peut être acheté dans de nombreuses quincailleries, magasins de rénovation domiciliaire et détaillants en ligne. Il peut également être disponible dans les magasins spécialisés de fournitures chimiques.
Q : Comment puis-je neutraliser l’acide oxalique dans les aliments ?
R : L’acide oxalique peut être neutralisé dans les aliments en ajoutant une substance riche en calcium, comme du lait ou du fromage. Le calcium se liera à l’acide oxalique, réduisant ainsi son effet sur le corps.
Q : Quel est le pourcentage en masse de carbone dans l’acide oxalique, H2C2O4 ?
R : Le poids moléculaire de l’acide oxalique est de 90,03 g/mol. La masse de carbone dans une mole d’acide éthanedioïque est de 24,02 g. Par conséquent, le pourcentage massique de carbone dans l’acide éthanedioïque est de (24,02 g/90,03 g) x 100 % = 26,66 %.
Q : Comment puis-je réduire l’acide oxalique dans les épinards ?
R : L’acide oxalique peut être réduit dans les épinards en blanchissant les épinards avant de les consommer. Ce processus consiste à faire bouillir les épinards pendant une courte période, puis à les refroidir dans de l’eau glacée pour réduire la teneur en acide éthanedioïque.
Q : Quel est le pourcentage en masse de carbone dans l’acide oxalique, H2C2O4 ?
R : Le poids moléculaire de l’acide oxalique est de 90,03 g/mol. La masse de carbone dans une mole d’acide éthanedioïque est de 24,02 g. Par conséquent, le pourcentage massique de carbone dans l’acide éthanedioïque est de (24,02 g/90,03 g) x 100 % = 26,66 %.
Q : H2C2O4 est-il un acide ou une base ?
R : H2C2O4 est un acide, également connu sous le nom d’acide éthanedioïque.
Q : Quel est l’ordre de réaction du H2C2O4 ? R : L’ordre de réaction du H2C2O4 dépend de la réaction spécifique en question. Elle peut être déterminée expérimentalement grâce à des méthodes telles que la méthode des taux initiaux ou les lois de taux intégrées.
