Le fluorure de potassium (KF) est un composé chimique composé d’ions K+ et F-. Il est utilisé dans diverses applications industrielles telles que la production d’aluminium et les produits dentaires.
| Nom UICPA | Fluorure de potassium |
| Formule moléculaire | KF |
| Numero CAS | 7789-23-3 |
| Synonymes | Monofluorure de potassium, fluorure de potassium, fluorure de potassium, UN 1812, EINECS 232-151-5 |
| InChI | InChI=1S/FH.K/h1H;/q;+1/p-1 |
Propriétés du fluorure de potassium
Formule de fluorure de potassium
La formule chimique du fluorure de potassium est KF, ce qui indique qu’un ion potassium et un ion fluorure se combinent pour former une seule unité de formule du composé. La formule du fluorure de potassium est utile pour déterminer la stœchiométrie des réactions chimiques impliquant le composé, ainsi que pour identifier les éléments présents dans un échantillon donné.
Fluorure De Potassium Masse molaire
KF a une masse molaire de 58,10 g/mol. C’est un composé composé d’ions K+ et F-, avec un ion potassium et un ion fluorure par unité de formule. La masse molaire est la somme des masses atomiques des éléments d’un composé, qui sont dans ce cas 39,10 g/mol pour le potassium et 19,00 g/mol pour le fluor. Connaître la masse molaire de KF est utile pour déterminer la quantité de composé présente dans un échantillon donné, ainsi que pour calculer les relations stoechiométriques dans les réactions chimiques.
Point d’ébullition du fluorure de potassium
KF a un point d’ébullition élevé de 1 503 °C (2 737 °F). Cela est dû à la forte liaison ionique entre les ions K+ et F-, qui nécessite une grande quantité d’énergie pour se briser et permettre au composé d’entrer dans la phase gazeuse. Le point d’ébullition du KF le rend utile dans les applications à haute température, comme dans la production d’aluminium, où il est utilisé comme fondant pour éliminer les impuretés du métal.
Fluorure de potassium Point de fusion
KF a un point de fusion relativement bas de 858°C (1 576°F). Cela est également dû à la nature ionique du composé, car la forte attraction entre les ions positifs et négatifs est affaiblie par l’augmentation de la température, permettant au composé d’entrer dans la phase liquide. Le faible point de fusion du KF le rend utile dans diverses applications, telles que la fabrication du verre et de la céramique.
Densité du fluorure de potassium g/mL
La densité du KF est de 2,48 g/mL à température ambiante. Cette valeur est influencée par la structure cristalline compacte du composé ainsi que par la masse relativement élevée des ions K+ et F-. La densité de KF est utile pour déterminer le volume occupé par une masse donnée du composé, ainsi que pour prédire son comportement dans divers environnements.
Fluorure De Potassium Poids moléculaire
Le poids moléculaire du KF est de 58,10 g/mol. Cette valeur est déterminée en additionnant les poids atomiques des ions K+ et F- dans une unité de formule du composé. Le poids moléculaire du KF est important pour déterminer ses propriétés physiques et chimiques, ainsi que pour calculer les relations stœchiométriques dans les réactions chimiques.
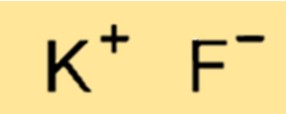
Structure du fluorure de potassium
KF a une structure cristalline composée d’une alternance d’ions K+ et F-. Les ions sont maintenus ensemble par de fortes liaisons ioniques, ce qui donne lieu à une structure très stable et rigide. La structure du KF est importante pour déterminer ses propriétés physiques et chimiques, ainsi que pour prédire son comportement dans diverses applications.
| Apparence | Solide cristallin blanc |
| Gravité spécifique | 2,48 à 20°C |
| Couleur | Incolore |
| Odeur | Inodore |
| Masse molaire | 58,10 g/mole |
| Densité | 2,48 g/mL à 20°C |
| Point de fusion | 858°C |
| Point d’ébullition | 1 503 °C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | 92,5 g/100 mL à 25°C |
| Solubilité | Soluble dans l’alcool, insoluble dans l’éther |
| La pression de vapeur | 1 mmHg à 737°C |
| Densité de vapeur | N’est pas applicable |
| pKa | 7.3 |
| pH | 7 (neutre) |
Sécurité et dangers du fluorure de potassium
KF peut être dangereux s’il n’est pas manipulé correctement. Il est très corrosif et peut provoquer de graves brûlures à la peau, aux yeux et au système respiratoire au contact. L’inhalation de poussières ou de vapeurs de KF peut irriter le système respiratoire et entraîner de la toux et un essoufflement. Une exposition à long terme au KF peut provoquer des lésions pulmonaires chroniques et une fluorose squelettique. Il est important d’utiliser des équipements de protection, tels que des gants et des lunettes, lors de la manipulation du KF, et d’éviter d’inhaler ses poussières ou ses vapeurs. En cas d’exposition, des soins médicaux immédiats doivent être recherchés.
| Symboles de danger | Crâne et os croisés, Corrosif |
| Description de la sécurité | Conserver sous clé et hors de portée des enfants. Ne respirez pas la poussière. Porter des vêtements de protection appropriés, des gants et une protection des yeux/du visage. En cas de contact avec les yeux, rincer immédiatement et abondamment à l’eau et consulter un médecin. En cas d’accident ou de malaise, consulter immédiatement un médecin (si possible lui montrer l’étiquette). |
| Numéros d’identification de l’ONU | UN1812 |
| Code SH | 2826.12.00 |
| Classe de danger | 6.1 |
| Groupe d’emballage | II |
| Toxicité | Très toxique ; DL50 orale (rat) 52 mg/kg |
Méthodes de synthèse du fluorure de potassium
Plusieurs méthodes peuvent synthétiser KF. Une méthode courante consiste à faire réagir l’acide fluorhydrique (HF) avec l’hydroxyde de potassium (KOH) . La réaction produit du KF et de l’eau, comme suit :
HF + KOH → KF + H2O
Une autre méthode est la réaction entre le carbonate de potassium (K2CO3) et l’acide fluorhydrique . La réaction produit du KF, de l’eau et du dioxyde de carbone, comme suit :
2HF + K2CO3 → 2KF + CO2 + H2O
À haute température, la réaction entre le fluorure d’hydrogène gazeux (HF) et le chlorure de potassium (KCl) produit du KF et du chlorure d’hydrogène gazeux (HCl).
KCl + HF → KF + HCl
Les méthodes ci-dessus nécessitent de la prudence car l’acide fluorhydrique ou le fluorure d’hydrogène sont hautement corrosifs et toxiques.
Utilisations du fluorure de potassium
Le fluorure de potassium a plusieurs utilisations dans différentes industries. Voici quelques-unes de ses utilisations :
- Comme flux en métallurgie : utilisé comme flux dans la production d’aluminium et d’autres métaux. Il permet d’éliminer les impuretés du métal et d’améliorer sa qualité.
- Dans la production d’autres produits chimiques : Utilisé dans la production de plusieurs autres produits chimiques, tels que la cryolite et le fluorure d’aluminium.
- Dans la production du verre : Ajouté au verre pour abaisser son point de fusion et améliorer sa durabilité et ses propriétés optiques.
- Dans la production de pesticides : Utilisé dans la production de certains pesticides comme stabilisant et catalyseur.
- Dans la production de dentifrice : ajouté au dentifrice comme supplément de fluorure pour prévenir la carie dentaire.
- Dans les réacteurs nucléaires : Utilisé dans les réacteurs nucléaires comme liquide de refroidissement et pour prévenir la corrosion des composants du réacteur.
- En chimie analytique : Utilisé en chimie analytique pour déterminer la concentration de certains éléments dans un échantillon.
Des questions:
Q : Qu’est-ce que KF en chimie ?
R : KF est la formule chimique du fluorure de potassium. C’est un composé inorganique composé d’un ion potassium et d’un ion fluorure.
Q : Le KF est-il un acide ou une base ?
R : KF est un sel qui n’est ni un acide ni une base. Cependant, il peut subir une hydrolyse dans l’eau pour produire une solution basique.
Q : Le fluorure de potassium conduit-il l’électricité ?
R : KF est un composé ionique qui peut conduire l’électricité lorsqu’il est dissous dans l’eau ou fondu. En effet, les ions peuvent se déplacer librement et transporter une charge électrique.
Q : Quelle est la formule du fluorure de potassium ?
R : La formule du fluorure de potassium est KF. Le composé est composé d’un ion K+ et d’un ion F-.
