Le silicate de sodium (Na2SiO3) est un composé composé de sodium, de silicium et d’oxygène. Il a de nombreuses utilisations, notamment comme détergent, adhésif et dans la production de gel de silice.
| Nom UICPA | Métasilicate de sodium |
| Formule moléculaire | Na2SiO3 |
| Numero CAS | 6834-92-0 |
| Synonymes | Verre à eau, verre liquide, verre soluble, orthosilicate de sodium, verre de silicate de sodium, métasilicate de sodium |
| InChI | InChI=1S/2Na.O3Si/c;;1-4(2)3/q2*+1;-2 |
Propriétés du silicate de sodium
Formule de silicate de sodium
La formule du silicate de sodium est Na2SiO3, ce qui indique que chaque unité du composé contient deux atomes de sodium, un atome de silicium et trois atomes d’oxygène. Le silicate de sodium est également connu sous d’autres formules telles que Na2O·nSiO2 et Na2SiO4, en fonction du nombre d’unités SiO2 dans l’anion polymère. La formule du silicate de sodium est cruciale pour comprendre ses propriétés chimiques et pour calculer sa masse molaire et son poids moléculaire.
Silicate De Sodium Masse molaire
Na2SiO3 a une masse molaire d’environ 122,06 g/mol. Ceci est calculé en ajoutant les masses atomiques de sodium (22,99 g/mol), de silicium (28,09 g/mol) et d’oxygène (16,00 g/mol) présentes dans le composé. La masse molaire est une propriété cruciale pour Na2SiO3 car elle aide à déterminer la quantité de composé nécessaire dans une réaction.
Point d’ébullition du silicate de sodium
Le point d’ébullition de Na2SiO3 n’est pas une valeur unique mais plutôt une plage de températures. Les solutions Na2SiO3, couramment utilisées dans les applications industrielles, ont une plage d’ébullition de 100 à 110 °C. Le point d’ébullition de Na2SiO3 dépend de facteurs tels que sa concentration, sa pureté et la présence d’impuretés.
Silicate De Sodium Point De Fusion
Na2SiO3 n’a pas de point de fusion distinct car il n’existe pas sous forme de composé solide dans des conditions normales. On le trouve généralement à l’état solide sous forme de poudres, de granulés ou de grumeaux. Ces formes solides de Na2SiO3 ont des points de fusion différents, qui varient en fonction de leur composition et de leur mode de préparation.
Densité du silicate de sodium g/mL
La densité des solutions Na2SiO3 varie en fonction de leur concentration. Les solutions Na2SiO3 avec une concentration de 20 % ont une densité d’environ 1,14 g/mL, tandis que celles avec une concentration de 40 % ont une densité d’environ 1,34 g/mL. La densité du Na2SiO3 solide peut varier de 2,3 g/mL à 2,6 g/mL, selon sa pureté et la taille de ses particules.
Silicate De Sodium Poids moléculaire
Le poids moléculaire de Na2SiO3, également connu sous le nom de poids de formule, est la somme des poids atomiques de tous les atomes présents dans le composé. Le poids moléculaire de Na2SiO3 est d’environ 122,06 g/mol. Connaître le poids moléculaire d’un composé est essentiel pour déterminer la quantité de composé nécessaire pour une réaction spécifique.
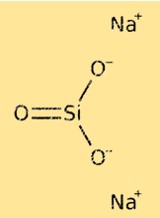
Structure de silicate de sodium
Le silicate de sodium est un composé inorganique composé de cations sodium et d’anions silicates polymères. La structure du silicate de sodium peut varier en fonction de sa composition et de son mode de préparation. Il est généralement représenté par la formule Na2O.nSiO2, où n représente le nombre d’unités SiO2 dans l’anion polymère. Les anions de silicate polymère ont une structure de réseau tridimensionnelle, dans laquelle les atomes de silicium sont coordonnés de manière tétraédrique avec les atomes d’oxygène.
| Apparence | Solide, liquide ou poudre incolore ou blanc |
| Gravité spécifique | 1,4-1,6 |
| Couleur | Incolore |
| Odeur | Inodore |
| Masse molaire | 122,06 g/mole |
| Densité | 1,14-1,34 g/mL (solution) ; 2,3-2,6 g/mL (solide) |
| Point de fusion | Pas de point de fusion distinct |
| Point d’ébullition | 100-110 °C (solution) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Soluble |
| Solubilité | Soluble dans l’eau et l’éthanol ; légèrement soluble dans le méthanol et l’acétone |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | ~9,8 |
| pH | 11-12 (solution) |
Sécurité et dangers du silicate de sodium
Na2SiO3 peut être dangereux s’il n’est pas manipulé correctement. C’est un composé caustique qui peut provoquer de graves irritations de la peau et des yeux au contact. L’inhalation de poussière ou de brouillard de Na2SiO3 peut provoquer une irritation respiratoire et des lésions pulmonaires. Les solutions Na2SiO3 sont également très alcalines et peuvent provoquer des brûlures chimiques sur la peau ou les muqueuses. Un équipement de protection individuelle approprié, tel que des gants et des lunettes de protection, doit être porté lors de la manipulation de Na2SiO3. En cas de contact avec la peau ou les yeux, un rinçage immédiat à l’eau est nécessaire. Na2SiO3 doit également être stocké dans un endroit frais, sec et bien ventilé, à l’écart des matériaux incompatibles.
| Symboles de danger | Corrosif, Irritant |
| Description de la sécurité | Tenir hors de portée des enfants. Evitez le contact avec les yeux, la peau et les vêtements. Porter des gants de protection/des vêtements de protection/un équipement de protection des yeux/du visage. EN CAS DE CONTACT AVEC LA PEAU : Laver abondamment à l’eau. EN CAS DE CONTACT AVEC LES YEUX : Rincer avec précaution à l’eau pendant plusieurs minutes. Retirez les lentilles de contact, si elles sont présentes et faciles à faire. Continuez à rincer. EN CAS D’INGESTION : Rincer la bouche. NE PAS faire vomir. Appelez un CENTRE ANTIPOISON ou un médecin si vous ne vous sentez pas bien. |
| Numéros d’identification de l’ONU | UN2922, UN1824 |
| Code SH | 2839.90.90 |
| Classe de danger | 8 |
| Groupe d’emballage | III |
| Toxicité | DL50 (orale, rat) = 1 280 mg/kg ; CL50 (inhalation, rat) >2,28 mg/L/4h |
Méthodes de synthèse du silicate de sodium
Plusieurs méthodes existent pour synthétiser Na2SiO3.
Une méthode courante consiste à fusionner de la silice avec du carbonate de sodium à haute température, ce qui produit du Na2SiO3 et du dioxyde de carbone comme sous-produits.
Une autre méthode consiste à faire réagir l’hydroxyde de sodium avec de la silice dans un récipient à haute pression à des températures élevées. Pour obtenir la concentration souhaitée, diluez la solution hautement concentrée de Na2SiO3 avec de l’eau.
Une troisième méthode consiste à dissoudre du gel de silice dans une solution d’hydroxyde de sodium , puis à chauffer et agiter le mélange pour favoriser la réaction. Cette méthode donne une solution claire et incolore de Na2SiO3.
Le rayonnement micro-ondes peut chauffer les réactifs, synthétisant Na2SiO3.
Ces méthodes produisent du Na2SiO3 avec une pureté et des rendements supérieurs à ceux des méthodes de synthèse traditionnelles.
De plus, certaines études ont exploré l’utilisation de ressources renouvelables telles que les cendres de balle de riz et les cendres de bagasse de canne à sucre comme sources de silice pour la synthèse de Na2SiO3, offrant ainsi une approche de production plus durable.
Utilisations du silicate de sodium
Na2SiO3 est un composé polyvalent avec de nombreuses applications dans diverses industries. Certaines des utilisations courantes du Na2SiO3 sont :
- Adhésifs et liants : Utilisés comme liant dans diverses applications telles que le carton, les boîtes en carton ondulé et le contreplaqué.
- Détergents et savons : Utilisé dans les détergents à lessive comme tampon alcalin et agent anti-redéposition.
- Traitement de l’eau : Utilisé dans le traitement de l’eau comme agent coagulant et comme inhibiteur de corrosion.
- Construction : Également utilisé comme durcisseur de béton et comme stabilisateur de sol.
- Céramique : Utilisée comme liant dans la production de céramique.
- Textile et papier : Utilisé comme agent d’encollage dans la production de papier et comme ignifuge dans les textiles.
- Automobile : Utilisé comme produit d’étanchéité et additif pour liquide de refroidissement dans l’industrie automobile.
- Agriculture : Utilisé comme pulvérisation foliaire pour améliorer la croissance des plantes et comme amendement du sol pour réduire le compactage du sol et augmenter la rétention d’eau.
- Protection incendie : Utilisé comme ignifuge dans divers matériaux tels que le bois, le tissu et le papier.
- Soins personnels : Utilisé dans certains dentifrices et déodorants comme liant et comme agent de contrôle de la viscosité.
Des questions:
Q : Le silicate de sodium est-il toxique ?
R : Na2SiO3 peut être toxique s’il est ingéré ou inhalé en grande quantité. Il peut irriter les yeux, la peau et le système respiratoire. Cependant, lorsqu’il est utilisé conformément aux directives de sécurité, comme le port d’un équipement de protection individuelle approprié, le Na2SiO3 est généralement sûr à manipuler.
Q : Comment guérir Na2SiO3 ?
R : Le Na2SiO3 est durci en l’exposant au dioxyde de carbone, ce qui provoque la solidification du Na2SiO3 liquide en une substance dure semblable à du verre. Le temps de durcissement dépend de la concentration de la solution Na2SiO3 ainsi que de la température et de l’humidité de l’environnement de durcissement. Généralement, il faut plusieurs jours pour que Na2SiO3 durcisse complètement.
Q : Peut-on peindre sur du béton traité au silicate de sodium ?
R : Oui, il est possible de peindre sur du béton traité au Na2SiO3, mais la surface doit être correctement préparée. Le Na2SiO3 doit durcir complètement, puis la surface doit être nettoyée et apprêtée avec un apprêt approprié avant d’appliquer la peinture.
Q : Où acheter du silicate de sodium près de chez moi ?
R : Na2SiO3 peut être acheté auprès de fournisseurs de produits chimiques, de fournisseurs industriels et de détaillants en ligne. Il est important de s’assurer que le fournisseur est réputé et que le Na2SiO3 est de haute qualité et adapté à l’application prévue. Il est également important de suivre les directives de manipulation et de sécurité appropriées lors de l’achat et de l’utilisation de Na2SiO3.
