Le silicate de calcium (Ca2SiO4) est un composé minéral utilisé dans les matériaux de construction, l’isolation et l’ignifugation. Il est fabriqué en combinant de l’oxyde de calcium et de la silice. Le silicate de calcium assure une isolation thermique et résiste au feu.
| Nom UICPA | Silicate de calcium |
| Formule moléculaire | Ca2SiO4 |
| Numero CAS | 1344-95-2 |
| Synonymes | Acide silicique, sel de calcium (2:1) ; Métasilicate de calcium ; Oxyde de calcium et de silicium ; Orthosilicate de calcium |
| InChI | InChI=1S/Ca.2O.Si/q+2;2*-1; |
Propriétés du silicate de calcium
Silicate De Calcium Masse molaire
Ca2SiO4 a une masse molaire de 172,237 g/mol. Cette valeur est calculée en additionnant les masses atomiques de calcium, de silicium et d’oxygène, qui sont respectivement de 40,078 g/mol, 28,085 g/mol et 15,999 g/mol. La masse molaire est importante pour déterminer la quantité de Ca2SiO4 nécessaire aux réactions chimiques ou à la préparation de solutions.
Point d’ébullition du silicate de calcium
Ca2SiO4 n’a pas de point d’ébullition défini car il se décompose avant d’atteindre son point d’ébullition. Lorsque le Ca2SiO4 est chauffé, il subit une série de réactions chimiques qui conduisent à la libération d’eau et à la formation d’oxyde de calcium et de silice. La température de décomposition du Ca2SiO4 dépend du type spécifique et de la composition du composé.
Silicate de Calcium Point de fusion
Ca2SiO4 a un point de fusion de 2130°C. À cette température, Ca2SiO4 passe de l’état solide à l’état liquide. Le point de fusion du Ca2SiO4 est relativement élevé, ce qui le rend adapté aux applications à haute température telles que les matériaux réfractaires, l’isolation et l’ignifugation.
Densité du silicate de calcium g/mL
La densité de Ca2SiO4 varie en fonction du type spécifique et de la composition du composé. La densité de Ca2SiO4 varie de 2,2 à 2,8 g/mL. La haute densité du Ca2SiO4 le rend utile pour les applications où le poids est un problème. Par exemple, il est utilisé comme granulat léger dans le béton.
Silicate De Calcium Poids moléculaire
Le poids moléculaire de Ca2SiO4 est de 172,237 g/mol. Cette valeur est déterminée en ajoutant les poids atomiques du calcium, du silicium et de l’oxygène au composé. Le poids moléculaire du Ca2SiO4 est utilisé dans divers calculs, tels que la détermination de la concentration des solutions ou de la quantité de composé nécessaire aux réactions chimiques.
Structure du silicate de calcium
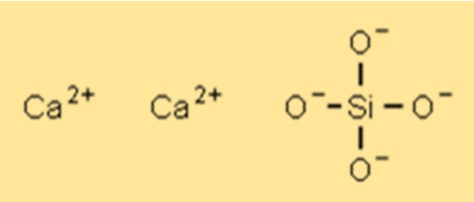
Ca2SiO4 a une structure cristalline qui peut varier en fonction du type spécifique et de la composition du composé. La structure cristalline la plus courante est un système cristallin monoclinique. La structure cristalline du Ca2SiO4 lui confère certaines propriétés telles qu’une résistance élevée, une stabilité thermique et une résistance chimique.
Formule de silicate de calcium
La formule chimique du silicate de calcium est Ca2SiO4. Cette formule représente le rapport calcium, silicium et oxygène dans le composé. La formule du silicate de calcium est importante pour déterminer ses propriétés et pour son utilisation dans diverses applications telles que le ciment, l’isolation et l’ignifugation.
| Apparence | Poudre blanche |
| Gravité spécifique | 2,2 – 2,8 g/cm³ |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 172,237 g/mole |
| Densité | 2,2 – 2,8 g/cm³ |
| Point de fusion | 2130°C |
| Point d’ébullition | Se décompose avant de bouillir |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Insoluble |
| Solubilité | Insoluble dans l’eau, soluble dans les acides |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | N’est pas applicable |
| pH | 7,0 – 9,0 |
Sécurité et dangers du silicate de calcium
Le Ca2SiO4 est généralement considéré comme sûr pour une utilisation dans diverses applications, notamment les matériaux de construction, l’isolation et les additifs alimentaires. Cependant, une inhalation prolongée ou excessive de poussières de Ca2SiO4 peut irriter le système respiratoire. Le contact cutané et oculaire avec Ca2SiO4 peut également irriter. Bien que le Ca2SiO4 ne soit pas considéré comme une substance dangereuse, il est important de le manipuler avec soin et de suivre les consignes de sécurité lorsque vous travaillez avec ce matériau. Des équipements de protection individuelle tels que des gants, des lunettes de sécurité et une protection respiratoire doivent être portés lors de la manipulation du Ca2SiO4 afin de minimiser les risques potentiels pour la santé.
| Symboles de danger | N’est pas applicable |
| Description de la sécurité | Pas une substance dangereuse |
| Numéros d’identification de l’ONU | N’est pas applicable |
| Code SH | 6810.19 |
| Classe de danger | N’est pas applicable |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | Faible toxicité ; peut provoquer une irritation respiratoire et cutanée en cas d’exposition prolongée ou excessive |
Méthodes de synthèse du silicate de calcium
Diverses méthodes peuvent synthétiser le Ca2SiO4.
Dans une méthode, l’oxyde de calcium (CaO) réagit avec la silice (SiO2) pour produire un mélange de silicates de calcium. Le four à haute température permet la synthèse de Ca2SiO4. Le mélange comprend Ca2SiO4 et Ca3SiO5. Un traitement ultérieur et un broyage du mélange produisent différentes qualités de poudre de Ca2SiO4.
Une autre méthode implique la réaction entre l’hydroxyde de calcium (Ca(OH)2) et la silice dans un autoclave à haute pression et température. Ce procédé produit une forme plus pure de Ca2SiO4, connue sous le nom de wollastonite (CaSiO3), qui a un large éventail d’applications, notamment comme charge dans les plastiques et les revêtements.
D’autres méthodes de synthèse du Ca2SiO4 incluent la réaction entre le chlorure de calcium (CaCl2) et le silicate de sodium (Na2SiO3) pour produire l’hydrate de Ca2SiO4 (CSH), qui est le principal liant du ciment Portland.
Divers réactifs et méthodes permettent la synthèse de Ca2SiO4 en le précipitant à partir d’une solution d’ions calcium et silicate.
Utilisations du silicate de calcium
Le Ca2SiO4 a un large éventail d’applications en raison de ses propriétés uniques, telles que la résistance aux températures élevées, la faible conductivité thermique et l’excellente résistance au feu. Voici quelques utilisations courantes du Ca2SiO4 :
- Isolation : Utilisé comme matériau isolant dans les applications à haute température telles que les revêtements de four, l’isolation de chaudière et les conduites de vapeur. Sa faible conductivité thermique en fait un isolant efficace dans ces environnements.
- Matériaux de construction : Utilisé dans divers matériaux de construction tels que les briques, les tuiles et le ciment. Sa résistance aux hautes températures et au feu en font un matériau idéal pour une utilisation dans les murs et plafonds coupe-feu.
- Additifs alimentaires : Utilisés comme agent antiagglomérant dans les produits alimentaires tels que le sucre en poudre et le sel. Sa capacité à absorber l’humidité et à empêcher l’agglutination en fait un choix populaire auprès des fabricants de produits alimentaires.
- Produits pharmaceutiques : utilisé comme excipient dans les produits pharmaceutiques, où il sert de liant, de désintégrant et d’agent d’écoulement.
- Cosmétiques : Utilisé en cosmétique comme agent gonflant et absorbant. Il contribue à améliorer la texture et la sensation des produits tels que les poudres pour le visage et les fonds de teint.
- Autres utilisations : Également utilisé dans la production de céramiques, de matériaux réfractaires et comme charge dans le caoutchouc et les plastiques.
Des questions:
Q : Comment éliminer le silicate de calcium d’une piscine ?
R : Pour éliminer le Ca2SiO4 d’une piscine, utilisez un nettoyant pour carrelage de piscine ou une solution d’acide muriatique et d’eau. Appliquez le nettoyant ou la solution sur la zone affectée et frottez avec une brosse à poils durs. Rincer abondamment à l’eau après le nettoyage.
Q : Comment fabriquer du silicate de calcium réfractaire à la maison ?
R : Il n’est pas recommandé de fabriquer du Ca2SiO4 réfractaire à la maison en raison des températures élevées et de l’équipement spécialisé requis. Il est préférable d’acheter des produits réfractaires Ca2SiO4 préfabriqués auprès d’un fournisseur réputé.
Q : Les composés de silicate de calcium s’hydratent pour former quels deux composés ?
R : Les composés Ca2SiO4 s’hydratent pour former du Ca2SiO4 hydraté (CSH) et de l’hydroxyde de calcium (Ca(OH)2). Ces composés jouent un rôle important dans la formation et la résistance du béton et d’autres matériaux cimentaires.
