Le bromure de potassium (KBr) est un composé chimique composé de potassium et de brome. Il est couramment utilisé en photographie, en médecine et en médecine vétérinaire comme anticonvulsivant pour les chiens.
| Nom UICPA | Bromure de potassium |
| Formule moléculaire | KBr |
| Numero CAS | 7758-02-3 |
| Synonymes | Bromure de potassium, sel de bromure de potassium, Kaliobromide, Bromopotassium |
| InChI | InChI=1S/BrH.K/h1H;/q;+1/p-1 |
Propriétés du bromure de potassium
Formule de bromure de potassium
La formule chimique du bromure de potassium est KBr. Cette formule représente le rapport des atomes dans le composé. L’ion K+ a une charge de +1 et l’ion Bri- a une charge de -1, ce qui donne un composé neutre. La formule est utilisée pour indiquer la composition du composé et est essentielle pour rédiger des équations chimiques équilibrées.
Bromure De Potassium Masse molaire
KBr a une masse molaire de 119,01 g/mol. Il est composé d’un atome de potassium et d’un atome de brome. La masse molaire est une caractéristique importante d’un composé car elle est utilisée pour déterminer le nombre de moles d’une substance dans un échantillon donné. Il est également utilisé en stœchiométrie pour calculer la masse d’un produit ou d’un réactif dans une réaction chimique.
Point d’ébullition du bromure de potassium
KBr a un point d’ébullition de 1 390 °C (2 534 °F). Ce point d’ébullition élevé est dû à la nature ionique du composé. Lorsqu’elles sont chauffées, les liaisons ioniques entre le potassium et le brome nécessitent une grande quantité d’énergie pour se rompre, ce qui entraîne un point d’ébullition élevé. Le KBr est couramment utilisé en laboratoire comme fluide caloporteur en raison de son point d’ébullition élevé.
Bromure de potassium Point de fusion
KBr a un point de fusion de 734°C (1 353°F). Tout comme le point d’ébullition, le point de fusion est également déterminé par la force des liaisons ioniques entre les atomes de potassium et de brome. Lorsqu’elles sont chauffées, les liaisons ioniques sont affaiblies et la structure du réseau cristallin du composé se décompose, ce qui donne un état liquide.
Densité du bromure de potassium g/mL
La densité du KBr est de 2,75 g/mL à température ambiante. La densité d’une substance est définie comme la masse d’une substance par unité de volume. La densité élevée du KBr est due à la structure cristalline serrée du composé. Cette propriété le rend utile dans la fabrication de matériaux optiques tels que des lentilles et des prismes.
Bromure De Potassium Poids moléculaire
Le poids moléculaire du KBr est de 119,01 g/mol. Cette valeur est calculée en additionnant les masses atomiques de potassium et de brome. Le poids moléculaire est utilisé dans les calculs chimiques tels que la détermination de la quantité d’une substance nécessaire pour préparer une solution d’une concentration spécifique.
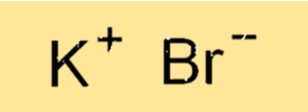
Structure du bromure de potassium
KBr a une structure cristalline constituée d’un réseau cubique à faces centrées. Chaque ion K+ est entouré de six ions Br-, et chaque ion Bri- est entouré de six ions K+. Cet arrangement est caractéristique des composés ioniques, qui ont un arrangement régulier et répétitif d’ions dans la structure cristalline.
| Apparence | Solide cristallin blanc |
| Gravité spécifique | 2,75 g/mL à 25°C |
| Couleur | Incolore |
| Odeur | Inodore |
| Masse molaire | 119,01 g/mole |
| Densité | 2,75 g/cm³ |
| Point de fusion | 734°C (1 353°F) |
| Point d’ébullition | 1 390 °C (2 534 °F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | 53 g/100 mL à 20°C |
| Solubilité | Soluble dans l’alcool, l’acétone et l’ammoniaque |
| Pression de vapeur | 1 mmHg à 1 114°C |
| Densité de vapeur | N’est pas applicable |
| pKa | 7,5 (à 25°C) |
| pH | 7 (neutre) |
Sécurité et dangers du bromure de potassium
Le KBr est généralement considéré comme étant sûr à utiliser, mais il peut présenter certains dangers s’il est mal manipulé. C’est un irritant cutané, oculaire et respiratoire, et son ingestion peut provoquer des troubles gastro-intestinaux. Une exposition prolongée à des concentrations élevées peut provoquer des problèmes respiratoires. Le KBr doit être manipulé avec précaution et un équipement de protection individuelle approprié, notamment des gants et un masque anti-poussière, doit être porté lors de la manipulation du composé. Il est également important de stocker le KBr dans un endroit frais, sec et bien ventilé, à l’écart des matériaux incompatibles. En cas d’exposition, consulter immédiatement un médecin.
| Symboles de danger | Xi – Irritant |
| Description de la sécurité | Eviter le contact avec la peau et les yeux. Porter des vêtements de protection appropriés, des gants et des lunettes/visage |
| protection. | |
| Numéros d’identification de l’ONU | UN 1465 (Produits chimiques, bromure de potassium) |
| Code SH | 28275100 |
| Classe de danger | 6.1 (Substances toxiques) |
| Groupe d’emballage | III |
| Toxicité | DL50 (orale, rat) = 2 340 mg/kg |
Méthodes de synthèse du bromure de potassium
Pour synthétiser le KBr, on peut utiliser diverses méthodes telles que la synthèse directe, la double décomposition et le titrage acide-base.
KOH réagit avec le gaz HBr pour produire du KBr en synthèse directe. La réaction produit du KBr et de l’eau comme sous-produits.
La double décomposition implique la réaction d’un sel de potassium soluble avec un sel de bromure soluble, tel que le chlorure de potassium et le bromure de sodium. La réaction produit du KBr et du chlorure de sodium .
Le titrage acide-base implique la réaction d’un sel de bromure avec KOH . L’acide sulfurique dilué traite d’abord le sel de bromure pour former du Hbr, puis KOH le titre pour produire du KBr et de l’eau.
Une autre méthode de synthèse du KBr implique la réaction du brome avec une solution chaude d’hydroxyde de potassium . Le sulfite de sodium réduit le bromate de potassium, produisant du KBr et du bromate de potassium.
Utilisations du bromure de potassium
KBr a plusieurs utilisations dans diverses industries en raison de ses propriétés uniques. Voici quelques-unes des utilisations courantes de KBr :
- Photographie : largement utilisé en photographie noir et blanc comme fixateur photographique pour empêcher la formation de buée sur le papier photographique.
- Médecine vétérinaire : Utilisé comme médicament anticonvulsivant pour les chiens et les chats souffrant de convulsions.
- Chimie analytique : utilisée comme étalon de référence dans la spectroscopie infrarouge à transformée de Fourier (FTIR) pour identifier les composés organiques.
- Chimie médicinale : utilisée dans la préparation de divers produits pharmaceutiques, notamment des sédatifs, des hypnotiques et des antiépileptiques.
- Forage pétrolier : Utilisé comme fluide de complétion dans le forage pétrolier pour empêcher l’afflux d’eau de formation et réduire le risque de corrosion.
- Retardateurs de flamme : utilisés comme ignifuges dans les plastiques, les textiles et les produits en papier.
- Synthèse chimique : Également utilisé dans les réactions de synthèse chimique, notamment dans la synthèse de divers composés organiques et inorganiques.
Des questions:
Q : Dans quelles conditions le bromure de potassium peut-il conduire l’électricité ?
R : Le KBr peut conduire l’électricité lorsqu’il est à l’état fondu ou lorsqu’il est dissous dans l’eau, ce qui permet à ses ions de se déplacer librement et de transporter une charge électrique.
Q : Le KBr est-il ionique ou covalent ?
R : KBr est un composé ionique formé par le transfert d’électrons du potassium au brome.
Q : Le KBr est-il soluble dans l’eau ?
R : Oui, le KBr est hautement soluble dans l’eau, avec une solubilité de 53,5 g/100 mL à 25°C.
Q : Quelle est la formule du bromure de potassium ?
R : La formule chimique du bromure de potassium est KBr.
Q : Le KBr est-il un acide ou une base ?
R : Le KBr est un sel et n’a pas de propriétés acides ou basiques.
Q : Qu’est-ce que le KBr ?
R : KBr est le symbole chimique du bromure de potassium, un composé ionique utilisé dans diverses industries pour ses propriétés uniques.
Q : De quelle masse de KBr (en grammes) avez-vous besoin pour préparer 250,0 ml d’une solution de 1,50 M de KBr ?
R : Pour préparer une solution de 1,50 M de KBr dans 250,0 ml d’eau, vous devrez dissoudre 30,4 grammes de KBr dans l’eau.
