L’iodure de magnésium est un composé chimique de formule MgI2. C’est un solide cristallin blanc hautement soluble dans l’eau et l’alcool. Le MgI2 est couramment utilisé comme source d’iode dans les réactions de synthèse organique.
| Nom de l’UICPA | Iodure de magnésium |
| Formule moléculaire | MgI2 |
| Numero CAS | 10377-58-9 |
| Synonymes | Diiodure de magnésium, iodure de magnésium (II), UNII-14R347R70C |
| InChI | InChI=1S/2HI.Mg/h2*1H;/q;;+2/p-2 |
Propriétés de l’iodure de magnésium
Formule d’iodure de magnésium
La formule chimique de l’iodure de magnésium est MgI2. Cette formule indique qu’une molécule d’iodure de magnésium est constituée d’un cation Mg2+ et de deux anions I-. La formule de l’iodure de magnésium est utile pour déterminer la stœchiométrie des réactions chimiques et prédire les produits des réactions chimiques impliquant le composé.
Iodure De Magnésium Masse molaire
MgI2 a une masse molaire de 278,113 g/mol. Cette valeur est obtenue en ajoutant la masse atomique d’un atome de Mg (24,305 g/mol) à la masse atomique de deux atomes de I (253,808 g/mol) présents dans une molécule de MgI2. La masse molaire du MgI2 est un paramètre important pour déterminer la masse d’une quantité donnée du composé, utile dans de nombreuses applications industrielles et scientifiques.
Point d’ébullition de l’iodure de magnésium
Le MgI2 a un point d’ébullition relativement élevé de 1 309°C. Cela indique qu’une quantité considérable d’énergie est nécessaire pour briser les forces d’attraction intermoléculaires entre les atomes de Mg et de I dans le composé. Le point d’ébullition du MgI2 le rend adapté aux applications à haute température, comme dans la fabrication de semi-conducteurs et d’autres composants électroniques.
Iodure de magnésium Point de fusion
Le point de fusion du MgI2 est de 637°C. A cette température, le solide MgI2 se transforme à l’état liquide. Le point de fusion du MgI2 est une propriété physique importante qui détermine son aptitude à diverses applications. Par exemple, le point de fusion élevé rend le MgI2 idéal pour être utilisé comme fondant dans la production d’alliages d’aluminium, où il est nécessaire de fondre les métaux ensemble pour créer un mélange homogène.
Densité d’iodure de magnésium g/mL
La densité du MgI2 est de 4,43 g/mL. Cette valeur indique la masse du composé présent dans un volume d’espace donné. La densité de MgI2 est un facteur important à prendre en compte lors de la détermination de la quantité de composé requise pour une application particulière. La haute densité du MgI2 le rend également utile comme matériau de protection dans les réacteurs nucléaires.
Iodure De Magnésium Poids moléculaire
Le poids moléculaire de MgI2 est de 278,113 g/mol. Cette valeur est la somme des poids atomiques des éléments constitutifs du composé, Mg et I. Le poids moléculaire de MgI2 est utile pour calculer la stœchiométrie des réactions chimiques et déterminer le nombre de moles du composé présent dans un échantillon donné.
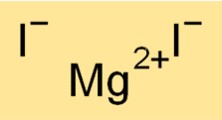
Structure de l’iodure de magnésium
MgI2 a une structure cristalline qui appartient au système cristallin hexagonal. La structure est constituée de cations magnésium et d’anions iodure disposés dans un réseau hexagonal. Les cations Mg2+ occupent le centre des cellules hexagonales, tandis que les anions I- occupent les coins des cellules. La structure cristalline du MgI2 contribue à ses propriétés physiques et chimiques, telles que ses points de fusion et d’ébullition élevés.
| Apparence | Solide cristallin blanc |
| Gravité spécifique | 4,43 g/ml |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 278,113 g/mole |
| Densité | 4,43 g/ml |
| Point de fusion | 637°C |
| Point d’ébullition | 1 309°C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Soluble |
| Solubilité | Soluble dans l’alcool, l’acétone |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | N’est pas applicable |
| pH | N’est pas applicable |
Sécurité et dangers de l’iodure de magnésium
Le MgI2 est généralement considéré comme sûr lorsqu’il est manipulé et utilisé correctement. Cependant, comme tout composé chimique, il peut présenter certains dangers s’il n’est pas manipulé avec précaution. Le MgI2 est classé comme irritant pour la peau et les yeux, et une exposition prolongée au composé peut provoquer une sensibilisation cutanée ou une irritation respiratoire. Il est important d’utiliser un équipement de protection individuelle approprié lors de la manipulation du MgI2, notamment des gants, une protection oculaire et un respirateur si nécessaire. De plus, le MgI2 peut réagir violemment avec l’eau, libérant de l’hydrogène gazeux inflammable. Il doit donc être stocké et manipulé à l’écart des sources d’humidité.
| Symboles de danger | Xi : Irritant |
| Description de la sécurité | S22 : Ne respirez pas la poussière. S24 : Éviter le contact avec la peau. S36/37/39 : Porter des vêtements de protection appropriés, des gants et un équipement de protection des yeux/du visage. |
| Numéros d’identification de l’ONU | UN3077 |
| Code SH | 28276000 |
| Classe de danger | 9 : Marchandises dangereuses diverses |
| Groupe d’emballage | III |
| Toxicité | Faible toxicité |
Méthodes de synthèse de l’iodure de magnésium
Il existe plusieurs méthodes de synthèse de MgI2, chacune ayant ses avantages et ses limites.
Une méthode courante implique la réaction du magnésium métallique avec l’iode dans un solvant éther anhydre ou tétrahydrofurane (THF). Cette réaction produit du MgI2 sous forme d’un précipité solide blanc.
Une autre méthode implique la réaction de l’oxyde de magnésium ou de l’hydroxyde de magnésium avec l’acide iodhydrique. Cette méthode consiste généralement à chauffer l’ oxyde ou l’hydroxyde de magnésium avec l’acide iodhydrique pour produire du MgI2.
La réaction du carbonate de magnésium ou de l’oxyde de magnésium avec l’iodure d’hydrogène gazeux produit également du MgI2. Cette réaction se produit généralement à des températures élevées et produit du MgI2 sous la forme d’un produit solide blanc.
Dans l’ensemble, le choix de la méthode de synthèse du MgI2 dépendra de facteurs tels que la pureté souhaitée du produit final, la disponibilité des matières premières et les conditions dans lesquelles la synthèse sera effectuée.
Utilisations de l’iodure de magnésium
MgI2 a de nombreuses utilisations dans différents domaines en raison de ses propriétés uniques. Voici quelques applications courantes de MgI2 :
- Comme catalyseur : utilisé comme catalyseur dans les réactions chimiques organiques, en particulier dans la formation de liaisons carbone-carbone.
- Dans la préparation des réactifs de Grignard : Utilisé dans la préparation des réactifs de Grignard. Les chimistes organiques utilisent les réactifs de Grignard pour synthétiser une large gamme de composés organiques.
- En médecine : Utilisé en médecine comme complément pour fournir à l’organisme le magnésium et l’iode essentiels, importants pour le maintien de fonctions corporelles saines.
- Dans les réacteurs nucléaires : utilisé dans les réacteurs nucléaires comme absorbeur de neutrons pour contrôler le taux de réactions de fission.
- Traitement photographique : utilisé dans le traitement photographique comme agent stabilisant pour empêcher l’oxydation et la dégradation des films photographiques.
- Dans la production de magnésium métallique : également utilisé comme précurseur dans la production de magnésium métallique, qui a un large éventail d’applications dans différentes industries.
Des questions:
Q : Quel type de dissolution MgI2 subirait-il ?
R : MgI2 subirait une dissolution ionique en raison de sa nature de composé ionique.
Q : Quelle est la formule chimique de l’iodure de magnésium ?
R : La formule chimique de l’iodure de magnésium est MgI2.
Q : Le MgI2 est-il soluble ?
R : Oui, MgI2 est soluble dans l’eau, l’alcool et l’éther.
Q : Quelle est la formule de l’iodure de magnésium ?
R : La formule de l’iodure de magnésium est MgI2.
Q : Quel type de composé est le MgI2 ?
R : MgI2 est un composé ionique, formé par le transfert de deux électrons du magnésium vers l’iode.
Q : Quel composé a la formule chimique MgI2 ?
R : Le composé de formule chimique MgI2 est l’iodure de magnésium.
Q : Quel est le nom du composé de formule MgI2 ?
R : Le nom du composé de formule MgI2 est Iodure de magnésium.
