L’iodure de potassium (KI) est un composé chimique utilisé pour empêcher l’absorption de l’iode radioactif par la glande thyroïde. Il est efficace lorsqu’il est pris avant ou peu de temps après une exposition à l’iode radioactif.
| Nom de l’UICPA | Iodure de potassium |
| Formule moléculaire | KI |
| Numero CAS | 7681-11-0 |
| Synonymes | kaliumiodide, monoiodure de potassium, iodure de K, KI |
| InChI | InChI=1S/HI.K/h1H;/q;+1/p-1 |
Propriétés de l’iodure de potassium
Formule d’iodure de potassium
La formule de l’iodure de potassium est KI. Cette formule représente le rapport le plus simple d’atomes de potassium et d’iode dans le composé. La formule de l’iodure de potassium est utilisée pour calculer la quantité de composé nécessaire dans diverses applications, ainsi que pour déterminer son poids moléculaire et d’autres propriétés.
Iodure De Potassium Masse molaire
Le KI a une masse molaire d’environ 166,0028 g/mol. Cette valeur est calculée en additionnant les poids atomiques de K et I dans le composé, qui sont respectivement de 39,0983 g/mol et 126,9045 g/mol. La masse molaire du KI est importante pour déterminer la quantité de composé nécessaire dans une réaction ou une application donnée.
Point d’ébullition de l’iodure de potassium
Le point d’ébullition du KI est de 1 330 °C (2 426 °F). Ce point d’ébullition élevé est dû à la forte liaison ionique entre les atomes de potassium et d’iode dans le composé. Le KI est utilisé dans les applications à haute température en raison de sa capacité à résister à une chaleur extrême sans se décomposer ni perdre son efficacité.
Iodure de potassium Point de fusion
Le point de fusion du KI est de 681 °C (1 258 °F). Ce point de fusion relativement bas rend le KI facile à manipuler et à traiter à des températures modérées. Le composé est couramment utilisé dans la production de films photographiques, de produits pharmaceutiques et en médecine nucléaire en raison de son faible point de fusion.
Densité d’iodure de potassium g/mL
La densité du KI est de 3,123 g/mL. Cette valeur est supérieure à celle de l’eau, ce qui rend le KI relativement lourd et dense. La densité du KI est importante pour déterminer sa solubilité dans divers solvants et dans ses applications en tant que radioprotecteur.
Iodure De Potassium Poids moléculaire
Le poids moléculaire du KI est d’environ 166,0028 g/mol. Cette valeur représente la somme des poids atomiques des éléments constitutifs du composé. Le poids moléculaire du KI est important pour déterminer ses propriétés et pour calculer sa concentration dans les solutions.
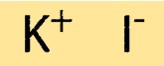
Structure de l’iodure de potassium
KI a une structure cristalline simple, constituée d’un arrangement cubique à faces centrées d’ions K+ et d’ions I-. Les ions sont maintenus ensemble par de fortes liaisons ioniques, qui confèrent au composé ses points de fusion et d’ébullition élevés. La structure cristalline du KI est importante pour comprendre ses propriétés physiques et chimiques.
| Apparence | poudre cristalline blanche |
| Densité spécifique | 3.123 |
| Couleur | incolore à blanc |
| Odeur | inodore |
| Masse molaire | 166,0028 g/mole |
| Densité | 3,123 g/mL |
| Point de fusion | 681 °C (1 258 °F) |
| Point d’ébullition | 1 330 °C (2 426 °F) |
| Point d’éclair | n’est pas applicable |
| Solubilité dans l’eau | 128 g/100 ml (20 °C) |
| Solubilité | soluble dans l’éthanol, l’acétone et le glycérol |
| Pression de vapeur | négligeable |
| Densité de vapeur | n’est pas applicable |
| pKa | 10.8 |
| pH | 6,0 – 9,0 (solution à 5 %) |
Sécurité et dangers de l’iodure de potassium
Le KI est généralement considéré comme sûr lorsqu’il est utilisé de manière appropriée. Cependant, comme tous les produits chimiques, il peut présenter des dangers s’il est mal manipulé ou utilisé de manière inappropriée. Le KI peut irriter la peau, les yeux et le système respiratoire, et une exposition prolongée peut entraîner des effets plus graves sur la santé. Il est également toxique s’il est ingéré en grande quantité. Des procédures appropriées de manipulation, de stockage et d’élimination doivent être suivies lorsque vous travaillez avec KI. De plus, des équipements de protection individuelle, tels que des gants et des lunettes de protection, doivent être portés lors de la manipulation du composé.
| Symboles de danger | XI |
| Description de la sécurité | Éviter de respirer les poussières/fumées/gaz/brouillards/vapeurs/aérosols. Porter des gants de protection/un équipement de protection des yeux/du visage. EN CAS D’INHALATION : Amener la victime à l’air frais et la maintenir au repos dans une position confortable pour respirer. EN CAS DE CONTACT AVEC LES YEUX : Rincer avec précaution à l’eau pendant plusieurs minutes. Retirez les lentilles de contact, si elles sont présentes et faciles à faire. Continuez à rincer. |
| Numéros d’identification de l’ONU | ONU 3077 |
| Code HS | 28276000 |
| Classe de danger | 9 – Matières dangereuses diverses |
| Groupe d’emballage | III |
| Toxicité | DL50 (orale, rat) > 10 000 mg/kg |
Méthodes de synthèse de l’iodure de potassium
Il existe plusieurs méthodes de synthèse du KI, mais l’une des plus courantes implique la réaction de l’iode avec l’hydroxyde de potassium ou le carbonate de potassium dans l’eau. L’équation de cette réaction est :
I2 + 2KOH → KI + KIO3 + H2O
Le processus produit du KI, de l’iodate de potassium et de l’eau comme sous-produits. Chauffer le mélange décompose l’iodate de potassium et laisse du KI pur.
Une autre méthode de synthèse du KI implique la réaction de l’iode avec du bisulfite de potassium dans l’eau. Cette réaction produit du KI ainsi que du dioxyde de soufre gazeux comme sous-produit. L’équation de cette réaction est :
I2 + 2KHSO3 → 2KI + 2SO2 + H2O
Le KI obtenu peut être purifié par recristallisation dans l’eau chaude.
Les algues contiennent des niveaux élevés d’iode, que les chimistes peuvent utiliser pour obtenir du KI. Le processus consiste à brûler des algues pour produire des cendres, à dissoudre les cendres dans l’eau et à les traiter avec de l’hydroxyde de potassium pour produire du KI.
Utilisations de l’iodure de potassium
Voici quelques utilisations courantes du KI :
- Radioprotection : Utilisée pour protéger la glande thyroïde des radiations en cas d’accident ou d’attaque nucléaire. Il agit en saturant la glande thyroïde avec de l’iode non radioactif, ce qui empêche l’absorption des isotopes de l’iode radioactif.
- Fins médicinales : Utilisé pour traiter les affections thyroïdiennes telles que l’hyperthyroïdie et le goitre. Également utilisé comme complément nutritionnel pour prévenir la carence en iode.
- Photographie : Utilisé comme composant dans les émulsions photographiques.
- Chimie analytique : Utilisé en chimie analytique pour déterminer la concentration d’agents oxydants dans un échantillon.
- Chimie organique : Utilisé dans les réactions de chimie organique comme source d’iode.
- Nutrition animale : utilisé comme additif alimentaire pour le bétail afin de prévenir la carence en iode et d’améliorer la santé globale.
- Détection d’amidon : utilisé comme réactif pour détecter la présence d’amidon dans les solutions.
- Agent réducteur : Agit comme agent réducteur dans certaines réactions chimiques.
Des questions:
Q : Où puis-je acheter de l’iodure de potassium près de chez moi ?
R : Vous pouvez acheter du KI dans de nombreuses pharmacies, magasins d’aliments naturels et détaillants en ligne. Il est souvent vendu comme complément nutritionnel ou comme agent de radioprotection.
Q : Quel groupe de clients ne devrait pas recevoir d’iodure de potassium ?
R : Les personnes souffrant de certaines affections thyroïdiennes ou allergiques à l’iode ne devraient pas prendre de KI. Il est important de consulter un professionnel de la santé avant de prendre des suppléments ou des médicaments.
Q : Quelle solution contient 6,0 pour cent (m/m) d’iodure de potassium (KI) dans l’eau ?
R : Une solution à 6,0 pour cent (m/m) de KI dans l’eau signifie que 6,0 grammes de KI sont dissous dans 100 grammes d’eau.
Q : Qu’est-ce que l’iodure de potassium ?
R : Le KI est un composé chimique composé de potassium et d’iode. Sa formule chimique est KI.
Q : Le KI est-il ionique ou covalent ?
R : L’iodure de potassium (KI) est un composé ionique. Il est formé par l’attraction électrostatique entre des ions potassium chargés positivement et des ions iodure chargés négativement.
Q : Le KI est-il soluble dans l’eau ?
R : Oui, l’iodure de potassium est hautement soluble dans l’eau. À température ambiante, environ 140 grammes de KI peuvent être dissous dans 100 millilitres d’eau.
Q : Qu’est-ce que le KI en chimie ?
R : En chimie, KI est la formule chimique de l’iodure de potassium, un composé utilisé dans diverses applications, notamment la radioprotection, à des fins médicinales et en chimie analytique.
