Le phosphate de potassium (K3PO4) est un composé qui contient les éléments potassium et phosphore. Il est couramment utilisé comme additif alimentaire et engrais en raison de sa haute solubilité et de sa capacité à fournir des nutriments essentiels à la croissance des plantes.
| Nom de l’UICPA | Phosphate de potassium |
| Formule moléculaire | K3PO4 |
| Numero CAS | 7778-53-2 |
| Synonymes | Phosphate tripotassique, orthophosphate de potassium, phosphate tertiaire de potassium, monophosphate tripotassique, phosphate tribasique de potassium |
| InChI | InChI=1S/3K.H3O4P/c;;;1-5(2,3)4/h;;;(H3,1,2,3,4)/q3*+1;/p-3 |
Propriétés du phosphate de potassium
Formule de phosphate de potassium
La formule chimique du phosphate de potassium est K3PO4. Cela indique que le composé contient trois ions K+ et un ion PO43- dans chaque unité de formule. La formule du phosphate de potassium est utile pour déterminer la stœchiométrie des réactions impliquant le composé, ainsi que pour identifier la quantité de chaque élément présent dans une masse donnée du composé.
Phosphate De Potassium Masse molaire
La masse molaire du K3PO4 est de 212,27 g/mol. Il est calculé en ajoutant les masses atomiques de potassium, de phosphore et d’oxygène au composé. La masse molaire est un paramètre important pour déterminer la quantité de substance présente dans une masse donnée du composé. Il est également utile pour calculer la stœchiométrie des réactions impliquant le K3PO4.
Point d’ébullition du phosphate de potassium
Le point d’ébullition du K3PO4 est de 1 660°C. Ce point d’ébullition élevé est dû aux fortes liaisons ioniques entre les ions K+ et les ions PO43- dans le composé. C’est également une indication de la stabilité du composé à haute température. Le point d’ébullition du K3PO4 est utile dans diverses applications industrielles, comme dans la production de céramique et de verre.
Point de fusion du phosphate de potassium
Le point de fusion du K3PO4 est de 1 340°C. C’est la température à laquelle le composé solide passe à l’état liquide. Le point de fusion élevé du K3PO4 est dû à la nature ionique du composé, qui nécessite une grande quantité d’énergie pour vaincre les forces d’attraction entre les ions. Le point de fusion du K3PO4 est utile pour déterminer son adéquation à diverses applications, telles que la production d’engrais et d’additifs alimentaires.
Densité du phosphate de potassium g/mL
La densité du K3PO4 est de 2,564 g/mL à température ambiante. La densité élevée du composé est due à la présence de trois ions K+ et d’un ion PO43- dans chaque unité de formule. La densité du K3PO4 est utile pour déterminer sa solubilité et son comportement dans divers processus industriels, comme dans la production d’engrais et d’additifs alimentaires.
Phosphate De Potassium Poids moléculaire
Le poids moléculaire du K3PO4 est de 212,27 g/mol. C’est la somme des poids atomiques de tous les atomes du composé. Le poids moléculaire est utile pour calculer la quantité de substance présente dans une masse donnée du composé, ainsi que pour déterminer la stœchiométrie des réactions impliquant K3PO4.
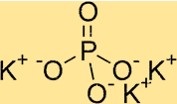
Structure du phosphate de potassium
K3PO4 a une structure cristalline orthorhombique. Il se compose d’un ensemble de tétraèdres PO4, chaque ion phosphate partageant deux atomes d’oxygène avec les ions phosphate voisins. Les ions potassium sont situés entre les tétraèdres phosphate, entourés d’atomes d’oxygène. La structure du K3PO4 est utile pour comprendre ses propriétés, telles que sa solubilité et sa stabilité thermique.
| Apparence | Poudre cristalline blanche |
| Densité spécifique | 2,564 g/mL |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 212,27 g/mole |
| Densité | 2,564 g/mL |
| Point de fusion | 1 340 °C |
| Point d’ébullition | 1 660 °C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | 100 g/L (20°C) |
| Solubilité | Soluble dans l’éthanol et l’acétone, insoluble dans l’éther |
| Pression de vapeur | Négligeable |
| Densité de vapeur | N’est pas applicable |
| pKa | pKa1 = 2,16, pKa2 = 7,21, pKa3 = 12,32 |
| pH | Le pH d’une solution à 1% est de 11,5 |
Sécurité et dangers du phosphate de potassium
Le K3PO4 est généralement considéré comme sûr à utiliser lorsqu’il est manipulé correctement. Cependant, comme tout produit chimique, il peut présenter des dangers s’il est mal manipulé ou ingéré en grande quantité. Le composé est classé comme irritant cutané, oculaire et respiratoire et peut provoquer de graves brûlures ou une détresse respiratoire s’il est inhalé ou ingéré à des concentrations élevées. Il est également incompatible avec les acides et les agents oxydants et peut provoquer un incendie ou une explosion s’il est exposé à ces matériaux. Par conséquent, il est important de manipuler le K3PO4 avec prudence, de porter un équipement de protection approprié et de le stocker dans un endroit frais, sec et bien ventilé, à l’écart des substances incompatibles.
| Symboles de danger | Xi (Irritant) |
| Description de la sécurité | Eviter le contact avec la peau et les yeux. |
| Numéros d’identification de l’ONU | UN 2833 (pour anhydre), UN 2423 (pour trihydrate) |
| Code SH | 28352400 |
| Classe de danger | 6.1 (toxique) |
| Groupe d’emballage | III |
| Toxicité | DL50 (orale, rat) : 2 340 mg/kg ; CL50 (inhalation, rat) : 50 mg/L |
Méthodes de synthèse du phosphate de potassium (K3PO4)
Plusieurs méthodes existent pour synthétiser le K3PO4, notamment la réaction de l’acide phosphorique (H3PO4) avec de l’hydroxyde de potassium (KOH) ou la décomposition thermique du KH2PO4.
Une méthode consiste à faire réagir des quantités équimolaires de KOH et de H3PO4 dans de l’eau à une température d’environ 60 à 80°C. La procédure consiste à évaporer le mélange résultant et à chauffer le résidu solide à environ 300°C pour produire du K3PO4.
Une autre méthode consiste à faire réagir KH2PO4 avec KOH à haute température (au-dessus de 400°C) pour produire du K3PO4 et de l’eau. Un four spécialisé peut effectuer ce processus appelé décomposition thermique.
La réaction de l’acide phosphorique avec le carbonate de potassium (K2CO3) et la réaction de l’oxyde de potassium (K2O) avec le pentoxyde de phosphore (P2O5) sont des méthodes supplémentaires pour produire du K3PO4.
Utilisations du phosphate de potassium
Le K3PO4 a plusieurs utilisations pratiques dans une gamme d’industries, notamment :
- Engrais : Couramment utilisé comme engrais en raison de sa teneur élevée en phosphore. Les agriculteurs l’ajoutent souvent au sol pour fournir les nutriments essentiels aux plantes.
- Industrie alimentaire : Utilisé comme additif alimentaire pour réguler les niveaux d’acidité, prévenir la décoloration et améliorer la texture.
- Agent tampon : Diverses applications de laboratoire l’utilisent comme agent tampon efficace, notamment les solutions tampons d’étalonnage du pH et la recherche biologique.
- Détergents : Utilisé dans la production de détergents et de produits de nettoyage en raison de sa capacité à adoucir l’eau et à empêcher l’accumulation de dépôts minéraux.
- Médecine : Utilisé comme complément alimentaire pour traiter certaines conditions médicales, telles que de faibles taux de phosphate dans le sang.
- Traitement de l’eau : Utilisé dans le traitement de l’eau pour prévenir la formation de tartre et de corrosion dans les canalisations et les équipements.
- Ignifuge : Utilisé comme ignifuge dans divers matériaux, notamment les textiles et les plastiques, en raison de sa capacité à libérer de la vapeur d’eau et à empêcher la propagation des flammes.
Des questions:
Q : Le phosphate de potassium est-il soluble dans l’eau ?
R : Oui, le K3PO4 est soluble dans l’eau.
Q : Combien d’ions potassium sont nécessaires pour se lier à un ion phosphate ?
R : Trois ions potassium sont nécessaires pour se lier à un ion phosphate, formant ainsi K3PO4.
Q : Quel précipité se forme lorsque des solutions aqueuses de bromure de calcium et de phosphate de potassium sont mélangées ?
R : Lorsque des solutions aqueuses de bromure de calcium et de K3PO4 sont mélangées, un précipité de phosphate de calcium (Ca3(PO4)2) se forme.
Q : Le k3po4 est-il soluble dans l’eau ?
R : Oui, le K3PO4 est soluble dans l’eau.
Q : Le k3po4 est-il soluble ?
R : Oui, le K3PO4 est soluble dans l’eau.
Q : Quels produits résultent du mélange de solutions aqueuses de Ni(C2H3O2)2 (aq) et de K3PO4 (aq) ?
R : Lorsque des solutions aqueuses de Ni(C2H3O2)2 et K3PO4 sont mélangées, un précipité de phosphate de nickel(II) (Ni3(PO4)2) se forme, ainsi que des solutions aqueuses d’acétate de potassium (KCH3COO) et d’acide acétique (CH3COOH).
Q : Quel élément augmente son nombre d’oxydation dans cette réaction ? 3KOH + H3PO4 → K3PO4 + 3H2O
R : L’élément phosphore augmente son indice d’oxydation de +5 dans H3PO4 à +5 dans K3PO4.
Q : Qu’est-ce que K3PO4 ?
R : K3PO4 est la formule chimique du phosphate de potassium, un composé utilisé dans diverses applications, telles que les engrais, les additifs alimentaires et les produits de nettoyage.
