L’hydroxyde de magnésium (Mg(OH)2) est un antiacide et un laxatif utilisé pour traiter les brûlures d’estomac, l’indigestion et la constipation. Il agit en neutralisant l’acide gastrique et en aspirant de l’eau dans le côlon pour favoriser les selles.
| Nom UICPA | L’hydroxyde de magnésium |
| Formule moléculaire | Mg(OH)2 |
| Numero CAS | 1309-42-8 |
| Synonymes | Lait de magnésie ; Brucite; Dihydroxyde de magnésium ; Hydromagnésite ; Magnésie blanche |
| InChI | InChI=1S/2H2O.Mg/h2*1H2;/q;;+2/p-2 |
Propriétés de l’hydroxyde de magnésium
Formule d’hydroxyde de magnésium
La formule chimique de l’hydroxyde de magnésium est Mg(OH)2. Cette formule indique qu’un atome de magnésium est lié à deux ions hydroxyde. La formule de l’hydroxyde de magnésium est utilisée pour calculer la masse molaire, la densité et d’autres propriétés physiques de la substance. La formule donne également un aperçu de la structure de la substance, car elle indique le nombre et les types d’atomes présents dans une molécule d’hydroxyde de magnésium.
Hydroxyde De Magnésium Masse molaire
La masse molaire de Mg(OH)2 est de 58,32 g/mol. Il s’agit de la masse d’une mole de Mg(OH)2, qui contient une mole d’atomes de Mg et deux moles d’ions OH-. La masse molaire est un concept important en chimie car elle est utilisée pour calculer la quantité de substance dans un échantillon donné.
Point d’ébullition de l’hydroxyde de magnésium
Le Mg(OH)2 n’a pas de point d’ébullition distinct car il se décompose avant d’atteindre son point d’ébullition. La température de décomposition du Mg(OH)2 est d’environ 350°C. Lorsqu’il est chauffé, Mg(OH)2 se décompose pour former de l’oxyde de magnésium et de l’eau.
Point de fusion de l’hydroxyde de magnésium
Le point de fusion du Mg(OH)2 est de 350°C. À cette température, le solide Mg(OH)2 passe à l’état liquide. Ce processus est connu sous le nom de fusion. Le point de fusion est une propriété physique importante d’une substance car il détermine la température à laquelle un solide se transforme en liquide.
Densité d’hydroxyde de magnésium g/mL
La densité de Mg(OH)2 est d’environ 2,36 g/mL. La densité est définie comme la masse d’une substance par unité de volume. Le Mg(OH)2 est une substance relativement dense en raison de sa masse molaire élevée et de la présence de deux ions OH- par atome de Mg.
Hydroxyde de magnésium Poids moléculaire
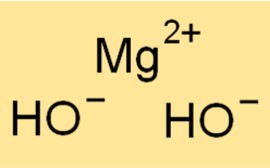
Le poids moléculaire de Mg(OH)2 est de 58,32 g/mol. C’est la somme des poids atomiques de tous les atomes d’une molécule de Mg(OH)2. Le poids moléculaire est un concept utile en chimie car il est utilisé pour déterminer la quantité d’une substance dans un échantillon donné.
Structure de l’hydroxyde de magnésium
Mg(OH)2 a une structure en couches composée d’ions Mg2+ et d’ions OH-. Les ions Mg2+ sont entourés de six ions OH-, et les ions OH- sont disposés dans une structure hexagonale compacte. La structure en couches du Mg(OH)2 donne naissance à ses propriétés caractéristiques, telles que sa faible solubilité dans l’eau et sa capacité à former une suspension dans l’eau.
| Apparence | Poudre ou suspension blanche |
| Gravité spécifique | 2,36 g/ml |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 58,32 g/mole |
| Densité | 2,36 g/ml |
| Point de fusion | 350°C |
| Point d’ébullition | Se décompose à 350°C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | 12 mg/L à 20°C |
| Solubilité | Insoluble dans l’éthanol et l’éther |
| La pression de vapeur | Négligeable |
| Densité de vapeur | N’est pas applicable |
| pKa | 10.4 |
| pH | 10.5 |
Sécurité et dangers de l’hydroxyde de magnésium
Le Mg(OH)2 est généralement considéré comme sûr à manipuler et à utiliser, avec une faible toxicité et aucun effet cancérigène connu. Cependant, une exposition prolongée à la poussière ou à la poudre de Mg(OH)2 peut provoquer une irritation respiratoire et des lésions pulmonaires. Le Mg(OH)2 peut également provoquer une irritation ou une corrosion des yeux, de la peau et des muqueuses au contact. Il est important de suivre les précautions de sécurité appropriées lors de la manipulation du Mg(OH)2, comme porter un équipement de protection et travailler dans un endroit bien ventilé. En cas de contact ou d’exposition, consulter un médecin et rincer soigneusement les zones touchées avec de l’eau.
| Symboles de danger | Aucun |
| Description de la sécurité | – Éviter l’inhalation et le contact avec les yeux, la peau et les vêtements. – Portez des vêtements de protection, des gants et une protection des yeux/du visage. – Utiliser dans un endroit bien ventilé. |
| Numéros d’identification de l’ONU | Non réglementé |
| Code SH | 2826.90.90 |
| Classe de danger | Non classés |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | Faible toxicité ; une exposition prolongée peut provoquer une irritation respiratoire et des lésions pulmonaires. |
Méthodes de synthèse de l’hydroxyde de magnésium
Diverses méthodes peuvent synthétiser le Mg(OH)2, telles que la précipitation, la synthèse hydrothermale et le dépôt électrochimique.
La méthode de précipitation consiste à faire réagir de l’hydroxyde de sodium ou de l’hydroxyde d’ammonium avec du chlorure de magnésium ou du sulfate de magnésium pour former du Mg(OH)2. La réaction produit du Mg(OH)2, que quelqu’un peut ensuite collecter et sécher.
Pour effectuer la synthèse hydrothermale, il faut chauffer l’eau à haute pression et température tout en ajoutant soit de l’oxyde de magnésium , soit du carbonate de magnésium . Le processus produira du Mg(OH)2 et vous pourrez collecter les cristaux en refroidissant la solution résultante.
Un dépôt électrochimique consiste à faire passer un courant électrique à travers une solution d’ions magnésium, les faisant réagir avec des ions hydroxyde et former du Mg(OH)2 sur la cathode.
D’autres méthodes de synthèse de Mg(OH)2 incluent l’utilisation d’ oxyde de magnésium et de lait de chaux et la décomposition thermique du bicarbonate de magnésium.
Chaque méthode présente ses avantages et ses inconvénients en termes d’efficacité, de rendement et de coût. Le choix de la méthode de synthèse dépend de l’application spécifique et des propriétés souhaitées du produit Mg(OH)2.
Utilisations de l’hydroxyde de magnésium
Le Mg(OH)2 a un large éventail d’applications dans diverses industries, notamment :
- Antiacide : Couramment utilisé comme antiacide pour neutraliser l’acide gastrique et soulager les brûlures d’estomac, l’indigestion et d’autres inconforts digestifs.
- Ignifuge : Un ignifuge non toxique utilisé dans les plastiques, le caoutchouc et les textiles pour réduire le risque d’incendie.
- Ajustement du pH : utilisé pour ajuster le pH de divers produits, notamment les solutions de traitement de l’eau, les cosmétiques et les produits pharmaceutiques.
- Assainissement de l’environnement : utilisé dans le traitement des eaux usées et du drainage minier acide pour neutraliser les conditions acides et éliminer les métaux lourds.
- Engrais : Utilisé comme engrais pour fournir du magnésium aux plantes et améliorer le pH du sol.
- Applications médicales : Utilisé comme laxatif et dans certaines procédures médicales, telles que les coloscopies, pour nettoyer l’intestin.
- Autres applications : Utilisé comme stabilisant dans la peinture au latex, comme agent blanchissant dans le papier et comme agent de polissage dans le verre et la céramique.
Des questions:
Q : Qu’est-ce qu’une base utilisée dans le dentifrice ?
R : Le Mg(OH)2 est couramment utilisé comme base dans les dentifrices pour aider à neutraliser les conditions acides dans la bouche et à réduire le risque de carie dentaire.
Q : Quelle est la formule de l’hydroxyde de magnésium ?
R : La formule chimique de l’hydroxyde de magnésium est Mg(OH)2.
Q : Quelle équation chimique montre la dissociation de l’hydroxyde de magnésium ?
R : L’équation chimique de la dissociation de Mg(OH)2 est
Mg(OH)2 → Mg2+ + 2OH-.
Q : L’hydroxyde de magnésium est-il soluble dans l’eau ?
R : Mg(OH)2 est peu soluble dans l’eau, ce qui signifie qu’il se dissout dans une mesure très limitée.
Q : Laquelle des substances suivantes est un acide d’Arrhenius ? BF3, HCN, NH3, Mg(OH)2 ?
R : Aucune des substances répertoriées n’est un acide d’Arrhenius. BF3 et HCN sont des acides de Lewis, NH3 est une base d’Arrhenius faible et Mg(OH)2 est une base d’Arrhenius forte.
Q : Le Mg(OH)2 est-il soluble dans l’eau ?
R : Mg(OH)2 est peu soluble dans l’eau, ce qui signifie qu’il se dissout dans une mesure très limitée.
Q : Quelle est la masse molaire de Mg(OH)2 ?
R : La masse molaire de Mg(OH)2 est d’environ 58,32 g/mol.
Q : Mg(OH)2 est-il un acide ou une base ?
R : Mg(OH)2 est une base, car elle est capable d’accepter des ions hydrogène (protons) pour former de l’eau et un sel.
