Le peroxyde de magnésium (MgO2) est un composé composé de magnésium et d’oxygène. Il est couramment utilisé en agriculture comme source d’oxygène à libération lente et comme amendement du sol pour améliorer la croissance des plantes.
| Nom UICPA | Peroxyde de magnésium |
| Formule moléculaire | MgO2 |
| Numero CAS | 14452-57-4 |
| Synonymes | Dioxyde de magnésium, magnésium; peroxyde, Permag, Magics, Oxy-Gen, EINECS 215-217-9 |
| InChI | InChI=1S/Mg.2O2/h;2*1H/q+2;;/p-2 |
Propriétés du peroxyde de magnésium
Formule de peroxyde de magnésium
La formule chimique du peroxyde de magnésium est MgO2. Cela signifie qu’une molécule de peroxyde de magnésium contient un atome de magnésium et deux atomes d’oxygène. La formule est importante car elle identifie le type et le nombre d’atomes présents dans le composé et aide à déterminer la stœchiométrie des réactions chimiques impliquant le peroxyde de magnésium.
Peroxyde De Magnésium Masse molaire
MgO2 a une masse molaire de 56,304 g/mol. Cela signifie qu’une mole de MgO2 contient 56,304 grammes du composé. La masse molaire est une propriété importante du MgO2 car elle aide à déterminer la quantité de substance nécessaire aux réactions chimiques.
Point d’ébullition du peroxyde de magnésium
Le MgO2 n’a pas de point d’ébullition défini car il se décompose avant de pouvoir bouillir. Lorsqu’il est chauffé, il se décompose en oxyde de magnésium et en oxygène gazeux. Cette propriété du MgO2 le rend utile comme source d’oxygène dans diverses applications.
Point de fusion du peroxyde de magnésium
Le MgO2 a un point de fusion de 223 °C. Cela signifie qu’à des températures supérieures à 700 °C, le composé solide se transforme en liquide. Le point de fusion est une propriété importante du MgO2 car il détermine le comportement du composé lorsqu’il est exposé à des températures élevées.
Densité du peroxyde de magnésium g/mL
La densité du MgO2 est de 2,41 g/mL. Cela signifie qu’un millilitre de MgO2 pèse 2,41 grammes. La densité est une propriété importante du MgO2 car elle aide à déterminer la masse d’un volume donné du composé.
Peroxyde De Magnésium Poids moléculaire
Le poids moléculaire du MgO2 est de 56,304 g/mol. Cela signifie qu’une molécule de MgO2 a une masse de 56,304 unités de masse atomique. Le poids moléculaire est une propriété importante du MgO2 car il aide à déterminer la quantité de substance nécessaire aux réactions chimiques.
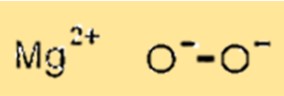
Structure du peroxyde de magnésium
MgO2 a une structure cristalline avec des ions magnésium occupant les sites octaédriques de la structure en réseau et des ions oxygène occupant les sites tétraédriques. Cette structure cristalline est importante car elle détermine les propriétés physiques et chimiques du MgO2.
| Propriété | Valeur |
| Apparence | poudre blanche |
| Gravité spécifique | 3,15 g/cm³ |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 56,304 g/mole |
| Densité | 2,41 g/ml |
| Point de fusion | 223 °C |
| Point d’ébullition | Se décompose avant de bouillir |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Insoluble |
| Solubilité | Soluble dans les acides |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | N’est pas applicable |
| pH | N’est pas applicable |
Sécurité et dangers du peroxyde de magnésium
Le MgO2 est généralement considéré comme sûr lorsqu’il est manipulé et utilisé correctement. Cependant, il peut être irritant pour la peau, les yeux et le système respiratoire. L’ingestion de grandes quantités peut provoquer une irritation gastro-intestinale, des vomissements et de la diarrhée. Il est important d’éviter d’inhaler la poudre et de porter des vêtements et équipements de protection lors de sa manipulation. Le MgO2 n’est ni inflammable ni explosif, mais il peut réagir avec certains produits chimiques tels que les acides et les oxydants puissants. Un stockage et une manipulation appropriés sont nécessaires pour éviter des réactions accidentelles. En cas d’exposition ou d’ingestion, consulter immédiatement un médecin.
| Symboles de danger | Ô, Xi |
| Description de la sécurité | Le peroxyde de magnésium peut provoquer une irritation de la peau et des yeux, ainsi qu’une irritation des voies respiratoires en cas d’inhalation. Il peut être nocif en cas d’ingestion ou de contact avec la peau et peut causer de graves lésions aux yeux. Il existe également un risque d’incendie s’il est exposé à la chaleur, aux flammes ou à des comburants. |
| Numéros d’identification de l’ONU | UN1479 |
| Code SH | 282910 |
| Classe de danger | 5.1 |
| Groupe d’emballage | II |
| Toxicité | Le peroxyde de magnésium peut provoquer une irritation de la peau et des yeux, ainsi qu’une irritation des voies respiratoires en cas d’inhalation. Il peut être nocif en cas d’ingestion ou de contact avec la peau et peut causer de graves lésions aux yeux. Il existe également un risque d’incendie s’il est exposé à la chaleur, aux flammes ou à des comburants. |
Méthodes de synthèse du peroxyde de magnésium
Il existe plusieurs méthodes pour synthétiser le MgO2, chacune ayant ses avantages et ses inconvénients.
Une méthode implique la réaction entre MgO et le peroxyde d’hydrogène . Dans cette méthode, vous mélangez du MgO avec une petite quantité d’eau pour former une pâte, puis vous ajoutez du peroxyde d’hydrogène tout en remuant le mélange. Le produit résultant est du MgO2 et de l’eau.
Une autre méthode implique la réaction entre Mg(OH)2 et le peroxyde d’hydrogène . Le chimiste dissout Mg(OH)2 dans l’eau pour former une solution, puis remue le mélange tout en ajoutant lentement du peroxyde d’hydrogène . Le produit résultant est du MgO2 et de l’eau.
Une troisième méthode implique la réaction directe entre le magnésium métallique et l’oxygène gazeux à haute température. Cette méthode nécessite un équipement spécialisé et n’est pas aussi couramment utilisée que les autres méthodes.
Utilisations du peroxyde de magnésium
Le MgO2 a diverses utilisations dans diverses industries, notamment :
- Applications environnementales – Utilisé comme composé libérant de l’oxygène dans l’assainissement des sols et des eaux souterraines pour décomposer les polluants.
- Agriculture – Utilisé comme engrais et amendement du sol en raison de ses propriétés d’oxygène à libération lente qui améliorent la croissance des plantes.
- Médical – Utilisé dans certaines formulations de dentifrices comme agent blanchissant et oxygénant pour la santé bucco-dentaire.
- Fabrication de produits chimiques – Utilisé dans la production de produits chimiques spécialisés tels que les époxydes, les peracides et les peresters.
- Transformation des aliments – Utilisé comme agent de blanchiment dans la farine et d’autres produits alimentaires.
- Industrie textile – Utilisé comme agent de blanchiment dans la production textile.
- Traitement de l’eau – Utilisé pour purifier l’eau en libérant de l’oxygène et en décomposant les composés organiques.
Des questions:
Q : À quoi sert le peroxyde de magnésium ?
R : Le MgO2 est utilisé dans diverses industries, telles que les applications environnementales, l’agriculture, le secteur médical, la fabrication de produits chimiques, la transformation des aliments, l’industrie textile et le traitement de l’eau.
Q : Quels sont les produits lorsque vous mélangez du peroxyde d’hydrogène et du sulfate de magnésium ?
R : Lorsque H2O2 et le sulfate de magnésium sont mélangés, les produits formés sont du MgO2, de l’eau et de l’oxygène gazeux.
Q : Le peroxyde de magnésium est-il utilisé dans les laboratoires ?
R : Oui, le MgO2 est utilisé dans les laboratoires à diverses fins telles que les réactions chimiques, le traitement de l’eau et l’assainissement de l’environnement.
Q : Le magnésium décompose-t-il le peroxyde d’hydrogène ?
R : Le magnésium ne décompose pas le H2O2 par lui-même. Cependant, le magnésium peut réagir avec H2O2 en présence d’un catalyseur, tel que l’iodure de potassium, pour libérer de l’oxygène gazeux.
Q : Lequel des éléments suivants n’est pas une unité de formule correcte ? k2o mgo2 al2o3 sro
R : Mgo2 n’est pas une unité de formule correcte. L’unité de formule correcte pour l’oxyde de magnésium est MgO.
Q : Quel est le(s) produit(s) de cette réaction combinée ? mgo + co2 mgo3 + c mgco3 mgo2 mgo + o2 co2 + o2
R : Le produit formé dans la réaction combinée du mgo et du co2 est le mgco3.
Q : Mgo2 liquide, gazeux ou solide ?
R : Mgo2 est un composé solide.
