Le nitrate de potassium (KNO3) est un sel cristallin blanc souvent utilisé dans les engrais, la conservation des aliments et les feux d’artifice. C’est également un ingrédient clé de certains dentifrices pour dents sensibles.
| Nom UICPA | Nitrate de potassium |
| Formule moléculaire | KNO3 |
| Numero CAS | 7757-79-1 |
| Synonymes | salpêtre; nitrate de potasse; nitre; salpêtre; E252 ; salpêtre chinois; acide nitrique, sel de potassium; Nitras de Kalii |
| InChI | InChI=1S/K.NO3/c;2-1(3)4/q+1;-1 |
Propriétés du nitrate de potassium
Formule de nitrate de potassium
La formule chimique du nitrate de potassium est KNO3. Cette formule montre que le composé est composé d’un ion potassium, d’un ion nitrate et de trois ions oxygène. La formule est utile pour calculer la quantité de nitrate de potassium nécessaire dans une réaction, ainsi que pour identifier les éléments et les ions présents dans le composé.
Nitrate De Potassium Masse molaire
KNO3 a une masse molaire de 101,1 g/mol. La masse molaire est la masse d’une mole d’une substance et est calculée en additionnant les masses atomiques de tous les atomes du composé. Dans le cas du KNO3, la masse molaire est calculée en additionnant la masse atomique d’un atome de potassium, d’un atome d’azote et de trois atomes d’oxygène. Cette valeur est utile pour déterminer la quantité de KNO3 nécessaire dans une réaction et pour calculer d’autres propriétés telles que la concentration.
Point d’ébullition du nitrate de potassium
KNO3 a un point d’ébullition relativement élevé de 1 336 °C (2 437 °F). Cela signifie qu’il faut beaucoup d’énergie pour rompre les liaisons entre les atomes du composé et le convertir d’un liquide en gaz. Cette propriété rend le KNO3 utile dans les applications nécessitant des réactions à haute température, comme dans la fabrication de feux d’artifice.
Point de fusion du nitrate de potassium
KNO3 a un point de fusion de 334 °C (633 °F). Cela signifie qu’à des températures supérieures à 334 °C, KNO3 passera d’un solide à un liquide. Cette propriété rend le KNO3 utile dans des applications telles que la fabrication du verre, où il est utilisé comme fondant pour abaisser le point de fusion de la silice.
Densité du nitrate de potassium g/mL
La densité du KNO3 est de 2,109 g/mL à température ambiante. La densité est une mesure de la masse par unité de volume d’une substance. La densité du KNO3 est importante dans des applications telles que la production d’engrais, où il est utilisé comme source d’azote et de potassium. La densité est également utile pour déterminer la quantité de KNO3 nécessaire dans un volume donné de solution.
Nitrate De Potassium Poids moléculaire
Le poids moléculaire du KNO3 est de 101,1 g/mol. Cette valeur est calculée en additionnant les poids atomiques de tous les atomes du composé. Le poids moléculaire est utile pour calculer d’autres propriétés du KNO3, telles que la quantité de KNO3 nécessaire dans une réaction ou la concentration d’une solution.
Structure du nitrate de potassium
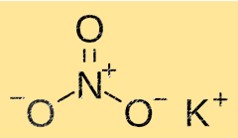
KNO3 a une structure cristalline composée d’ions potassium, nitrate et oxygène. Les ions potassium sont entourés de six ions nitrate, tandis que les ions nitrate sont entourés de six ions potassium. Cette structure confère au KNO3 ses propriétés caractéristiques telles que la solubilité, le point de fusion et la densité.
| Apparence | Poudre cristalline blanche |
| Gravité spécifique | 2,109 g/cm³ à 20°C |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 101,1032 g/mole |
| Densité | 2,109 g/cm³ |
| Point de fusion | 334°C (633°F) |
| Point d’ébullition | 400°C (752°F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | 133 g/L à 20°C |
| Solubilité | Soluble dans le glycérol, l’ammoniaque et l’eau |
| Pression de vapeur | Négligeable |
| Densité de vapeur | N’est pas applicable |
| pKa | 4,75 |
| pH | 6,9 – 7,3 |
Sécurité et dangers du nitrate de potassium
Le KNO3 est relativement sûr lorsqu’il est manipulé correctement, mais il peut présenter des dangers s’il est mal manipulé. Il est classé comme comburant, ce qui signifie qu’il peut favoriser la combustion d’autres matériaux. Le KNO3 peut également irriter les yeux, la peau et les voies respiratoires, et peut être toxique s’il est ingéré ou inhalé en grande quantité. Il est important de porter des équipements de protection tels que des gants, des lunettes et un respirateur lors de la manipulation du KNO3, et de le stocker dans un endroit frais et sec, à l’écart des matériaux inflammables. Des méthodes d’élimination appropriées doivent également être suivies pour éviter la contamination de l’environnement.
| Symboles de danger | O, Xn |
| Description de la sécurité | Tenir à l’écart de la chaleur/des étincelles/des flammes nues/des surfaces chaudes. Porter des gants de protection/un équipement de protection des yeux/du visage. EN CAS D’INGESTION : Appelez un CENTRE ANTIPOISON/un médecin si vous ne vous sentez pas bien. Rincer la bouche. NE PAS faire vomir. EN CAS D’INHALATION : Amener la victime à l’air frais et la maintenir au repos dans une position confortable pour respirer. Appelez un CENTRE ANTIPOISON/un médecin. |
| Numéros d’identification de l’ONU | 1486 |
| Code SH | 2834.21.00 |
| Classe de danger | 5.1 |
| Groupe d’emballage | III |
| Toxicité | Peut provoquer une irritation respiratoire, de la toux et un essoufflement en cas d’inhalation. Peut causer une irritation des yeux et de la peau. L’ingestion peut provoquer des douleurs abdominales, des nausées, des vomissements et de la diarrhée. Peut être toxique en cas d’ingestion ou d’inhalation en grande quantité. |
Méthodes de synthèse du nitrate de potassium
Plusieurs méthodes peuvent synthétiser le KNO3.
Une méthode courante est la réaction entre l’hydroxyde de potassium et l’acide nitrique . Le récipient de réaction mélange les deux substances et les chauffe à une température élevée, généralement autour de 80°C. Après cela, le mélange refroidit et le processus de filtration récupère le solide KNO3.
Une autre méthode est la réaction entre le chlorure de potassium et le nitrate de sodium. Une personne mélange les deux substances dans un récipient de réaction et les chauffe à haute température, généralement autour de 600°C.
Le mélange résultant fond puis se solidifie, formant des cristaux de KNO3.
Une troisième méthode implique l’oxydation de l’ammoniac par l’acide nitrique en présence d’un catalyseur. Cette méthode est plus complexe et généralement utilisée à l’échelle industrielle.
On peut extraire le KNO3 de sources naturelles, telles que des grottes et des dépôts souterrains. Cependant, cette méthode est moins courante en raison des faibles rendements et des impuretés présentes dans le KNO3 extrait.
Utilisations du nitrate de potassium
KNO3 a un large éventail d’utilisations dans diverses industries en raison de ses propriétés chimiques. Voici quelques utilisations courantes de KNO3 :
- Engrais – Utilisé comme engrais en raison de sa teneur élevée en azote et en potassium. Il est particulièrement utile pour les cultures qui nécessitent des niveaux élevés de potassium, comme les fruits, les légumes et le tabac.
- Conservation des aliments – Également utilisé comme conservateur alimentaire, en particulier dans les charcuteries. Il inhibe la croissance des bactéries et prévient la détérioration, prolongeant ainsi la durée de conservation du produit.
- Pyrotechnie – C’est un élément clé dans la fabrication de feux d’artifice et autres dispositifs pyrotechniques. Il agit comme un oxydant, produisant de l’oxygène pour alimenter la combustion d’autres matériaux.
- Dentifrice – Ajouté à certains dentifrices pour réduire la sensibilité dentaire. Il agit en bloquant la transmission des signaux de douleur du nerf dentaire au cerveau.
- Utilisations médicinales – Utilisé en médecine pour ses propriétés diurétiques et expectorantes. Il traite également l’angine de poitrine et l’hypertension.
- Applications industrielles – Également utilisé dans diverses applications industrielles, telles que la production de verre, de céramique et de colorants.
Des questions:
Q : Le nitrate de potassium est-il soluble dans l’eau ?
R : Oui, KNO3 est hautement soluble dans l’eau. À température ambiante, 100 grammes d’eau peuvent dissoudre environ 37 grammes de KNO3.
Q : À quoi sert le nitrate de potassium ?
R : KNO3 est utilisé à diverses fins, notamment comme engrais, conservateur alimentaire, oxydant pyrotechnique, ingrédient de dentifrice et comme composant dans la production de verre, de céramique et de colorants.
Q : Qu’est-ce que le nitrate de potassium ?
R : Le nitrate de potassium, également connu sous le nom de salpêtre, est un composé chimique de formule KNO3. C’est un sel ionique composé d’ions potassium (K+) et d’ions nitrate (NO3-).
Q : Qu’est-ce qui neutralise le nitrate de potassium ?
R : Les ions calcium et magnésium peuvent contrecarrer les effets nocifs d’un apport excessif de KNO3 dans les plantes. Chez l’homme, il n’existe pas d’antidote connu contre l’empoisonnement au KNO3 et le traitement est d’un grand secours.
Q : Le kno3 est-il soluble dans l’eau ?
R : Oui, KNO3 est hautement soluble dans l’eau.
Q : Quel est un produit de l’électrolyse de l’eau contenant une faible concentration de kno3 ?
R : Les produits de l’électrolyse de l’eau contenant une faible concentration de KNO3 sont l’hydrogène gazeux (H2) et l’oxygène gazeux (O2).
Q : Qu’est-ce que kno3 ?
R : KNO3 est la formule chimique du nitrate de potassium, également connu sous le nom de salpêtre.
Q : Quel est l’état d’oxydation d’un atome d’azote individuel dans kno3 ?
R : Dans KNO3, l’état d’oxydation de chaque atome d’azote est +5.
Q : Le kno3 est-il un acide ou une base ?
R : KNO3 n’est ni un acide ni une base. C’est un sel, composé d’un cation (K+) et d’un anion (NO3-).
