Le fluorure de cuivre (CuF2) est un composé formé de cuivre et de fluor. Il présente une couleur bleu verdâtre et trouve des applications dans diverses industries, notamment l’électronique et la catalyse.
| Nom UICPA | Fluorure de cuivre(II) |
| Formule moléculaire | CuF2 |
| Numero CAS | 7789-19-7 |
| Synonymes | Fluorure cuivrique, Difluorure de cuivre |
| InChI | InChI=1S/2FH.Cu/h2*1H;/q;;+2/p-2 |
Propriétés du fluorure de cuivre
Formule de fluorure de cuivre
La formule du difluorure de cuivre est CuF2. Il se compose d’un atome de cuivre (Cu) et de deux atomes de fluor (F). Ce composé ionique forme une structure cristalline stable en raison de l’attraction électrostatique entre l’ion cuivre chargé positivement et les ions fluorure chargés négativement.
Fluorure De Cuivre Masse molaire
La masse molaire du difluorure de cuivre (CuF2) est calculée en additionnant les masses atomiques de ses éléments constitutifs. Le cuivre a une masse molaire d’environ 63,55 g/mol et le fluor a une masse molaire d’environ 18,99 g/mol. En les additionnant, nous obtenons la masse molaire du difluorure de cuivre d’environ 101,09 g/mol.
Point d’ébullition du fluorure de cuivre
Le difluorure de cuivre n’a pas de point d’ébullition bien défini, car il subit une décomposition avant d’atteindre un point d’ébullition. À des températures élevées, le difluorure de cuivre commence à se décomposer en difluorure de cuivre (CuF) et en fluor gazeux (F2). De ce fait, il est considéré comme thermiquement instable.
Point de fusion du fluorure de cuivre
Le difluorure de cuivre a un point de fusion d’environ 840°C (1544°F). À cette température, les cristaux solides de difluorure de cuivre absorbent suffisamment d’énergie pour passer à l’état fondu, ce qui leur permet d’être utilisés dans diverses applications à haute température.
Densité du fluorure de cuivre g/mL
La densité du difluorure de cuivre est d’environ 4,23 g/mL. Cette valeur de densité indique que le difluorure de cuivre est un matériau relativement dense, ce qui peut être utile dans des applications spécifiques où une densité élevée est requise.
Fluorure De Cuivre Poids moléculaire
Le poids moléculaire du difluorure de cuivre (CuF2) est d’environ 101,09 g/mol. Il est calculé en additionnant les poids atomiques du cuivre et de deux atomes de fluor présents dans la formule.
Structure du fluorure de cuivre
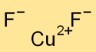
Le difluorure de cuivre adopte une structure cristalline, formant un arrangement en forme de réseau de cations Cu2+ et d’anions F-. Les cations cuivre sont entourés de six ions fluorure et chaque ion fluorure est en contact avec trois ions cuivre.
Solubilité du fluorure de cuivre
Le difluorure de cuivre présente une faible solubilité dans l’eau. Il forme des sels peu solubles qui libèrent des ions Cu2+ et F- dans la solution. Cette propriété est importante dans divers processus et applications chimiques, notamment la synthèse inorganique et les applications électrochimiques.
| Apparence | Solide bleu verdâtre |
| Gravité spécifique | 4,23 g/ml |
| Couleur | Bleu verdâtre |
| Odeur | Inodore |
| Masse molaire | 101,09 g/mole |
| Densité | 4,23 g/cm³ |
| Point de fusion | 840°C (1544°F) |
| Point d’ébullition | Se décompose |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Faible, forme des sels peu solubles |
| Solubilité | Peu soluble |
| La pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | N’est pas applicable |
| pH | Neutre |
Sécurité et dangers du fluorure de cuivre
Le difluorure de cuivre soulève plusieurs considérations en matière de sécurité et de danger. Le contact direct avec le composé peut provoquer une irritation de la peau et des yeux. L’inhalation de ses poussières ou de ses fumées peut entraîner des problèmes respiratoires. Lorsqu’il est chauffé, il peut libérer du fluor gazeux toxique, nocif en cas d’inhalation. Par conséquent, une ventilation adéquate et un équipement de protection individuelle doivent être utilisés lors de la manipulation du difluorure de cuivre. De plus, il est essentiel d’éviter l’ingestion car cela peut entraîner des troubles gastro-intestinaux. Le composé doit être stocké dans des récipients scellés, à l’écart des matériaux incompatibles pour éviter les réactions. Des protocoles de sécurité et des pratiques de manipulation appropriés sont essentiels pour minimiser les risques associés au difluorure de cuivre.
| Symboles de danger | Irritant |
| Description de la sécurité | Provoque une irritation de la peau et des yeux. Nocif en cas d’inhalation. Peut libérer du fluor gazeux toxique lorsqu’il est chauffé. Évitez d’ingérer. Utilisez une ventilation et un équipement de protection appropriés. |
| Numéros d’identification de l’ONU | N / A |
| Code SH | 2826.92.00 |
| Classe de danger | 6.1 (Substances toxiques) |
| Groupe d’emballage | III |
| Toxicité | Toxique |
Méthodes de synthèse du fluorure de cuivre
Diverses méthodes permettent de synthétiser le difluorure de cuivre. Une approche courante consiste à ajouter de l’oxyde de cuivre (CuO) ou du carbonate de cuivre (CuCO3) dans un récipient et à remuer soigneusement tout en ajoutant de l’acide fluorhydrique (HF) au récipient. La réaction se poursuit, produisant du difluorure de cuivre et de l’eau comme sous-produits.
Une autre méthode consiste à faire réagir du cuivre métallique ou de la poudre de cuivre avec du fluor gazeux (F2) à des températures élevées. Ce processus nécessite une manipulation prudente en raison de la réactivité du fluor gazeux. Il forme du difluorure de cuivre directement grâce à la combinaison d’atomes de cuivre et de fluor.
De plus, la préparation du difluorure de cuivre peut se produire en faisant réagir du chlorure de cuivre (II) (CuCl2) avec du fluorure de sodium (NaF) dans une solution aqueuse. La réaction donne du difluorure de cuivre ainsi que du chlorure de sodium comme sous-produit.
Ces méthodes de synthèse nécessitent des mesures de sécurité et des équipements appropriés en raison de la réactivité de certains des produits chimiques impliqués. Un contrôle précis des conditions de réaction est crucial pour obtenir des rendements élevés de difluorure de cuivre pur.
Utilisations du fluorure de cuivre
Le difluorure de cuivre trouve une gamme d’applications précieuses en raison de ses propriétés et caractéristiques uniques. Voici quelques utilisations clés :
- Électronique : Le difluorure de cuivre est utilisé dans l’industrie des semi-conducteurs comme source d’ions cuivre pour les processus de dépôt de couches minces. Il sert de précurseur dans la fabrication d’appareils électroniques et de circuits intégrés.
- Catalyse : Il agit comme catalyseur dans diverses réactions chimiques, notamment la synthèse de composés organiques et dans des processus industriels comme les réactions de fluoration.
- Source de fluor : Le difluorure de cuivre est utilisé pour produire du fluor gazeux (F2) par décomposition à haute température, ce qui est essentiel pour diverses applications industrielles.
- Céramique et verre : Le composé est utilisé comme additif dans la fabrication de la céramique et du verre pour modifier les propriétés du matériau et améliorer ses performances.
- Matériaux dentaires : Le difluorure de cuivre est incorporé dans les produits dentaires, tels que le dentifrice et les bains de bouche, pour améliorer leurs propriétés anti-caries et antibactériennes.
- Revêtements : il entre dans la composition de revêtements spécialisés, tels que les revêtements antireflet pour les dispositifs optiques et les revêtements protecteurs pour les surfaces métalliques.
- Ignifugeants : Le difluorure de cuivre est utilisé comme additif dans les matériaux ignifuges, contribuant ainsi à réduire l’inflammabilité de divers produits.
- Réactif chimique : Dans les laboratoires et la recherche, le difluorure de cuivre est utilisé comme réactif dans des réactions et analyses chimiques spécifiques.
La polyvalence du difluorure de cuivre le rend précieux dans tous les secteurs, de l’électronique aux soins de santé, où ses propriétés uniques sont exploitées pour améliorer les performances et la sécurité. Cependant, une manipulation appropriée et des précautions de sécurité sont essentielles en raison de sa réactivité et de ses dangers potentiels.
Des questions:
Q : Quelle est la formule de masse du fluorure de cuivre (II) ?
R : La masse de formule du difluorure de cuivre (II) (CuF2) est d’environ 101,09 g/mol.
Q : Laquelle des formules suivantes est la formule correcte pour le fluorure de cuivre (II) ?
R : La formule correcte pour le difluorure de cuivre (II) est CuF2.
Q : Le cuivre nettoie-t-il le fluorure ?
R : Non, le cuivre ne nettoie pas le difluorure. Le cuivre n’a pas la capacité d’éliminer le difluorure de l’eau.
Q : Quel est le composé covalent de NaCl, KCl, CuF2 et CF4 ?
R : Le composé covalent est le CF4 (tétrafluorure de carbone).
Q : Lorsqu’une solution aqueuse de CuF2 est électrolysée, qu’est-ce qui se forme au niveau des électrodes ?
R : À l’anode, de l’oxygène gazeux (O2) se forme et à la cathode, du cuivre métallique (Cu).
Q : Quel est le nom de CuF2 dans le système Stock ?
R : Le nom de CuF2 dans le système Stock est difluorure de cuivre (II).
Q : Quelle est la charge de l’ion cuivre dans le composé CuF2 ?
R : La charge de l’ion cuivre dans CuF2 est de +2.
Q : Le CuF2 est-il ionique ou moléculaire ?
R : CuF2 est un composé ionique.
Q : Quelle est la charge du composé ionique CuF2 ?
R : Le composé ionique CuF2 est neutre.
Q : Quel est le nom du composé de formule CuF2 ?
R : Le nom du composé de formule CuF2 est difluorure de cuivre (II).
