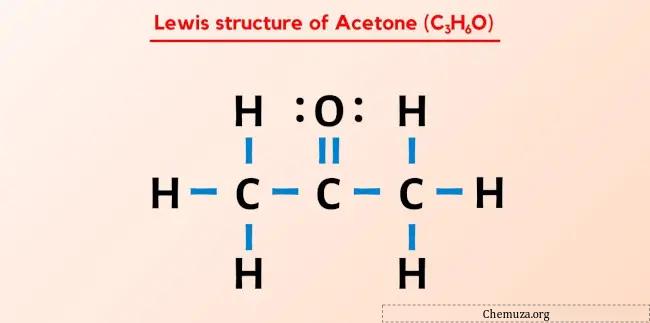
La structure de Lewis de l’acétone (également connue sous le nom de propanone ou C3H6O) comporte trois atomes de carbone (C) consécutifs, qui ont un atome d’oxygène (O) doublement lié à l’atome de carbone central (C) et trois atomes d’hydrogène (H) simples liés à chaque atome de carbone externe (C). Il y a 2 paires libres sur l’atome d’oxygène (O).
Comprenons la structure de Lewis de l’acétone en étapes simples.
Étapes de dessin de la structure Lewis de l’acétone (C3H6O)
Étape 1 : Trouver le nombre total d’électrons de valence dans la molécule C3H6O
Afin de trouver le nombre total d’électrons de valence dans une molécule C3H6O, vous devez tout d’abord connaître les électrons de valence présents dans l’atome de carbone, l’atome d’hydrogène ainsi que l’atome d’oxygène.
(Les électrons de valence sont les électrons présents sur l’ orbite la plus externe de tout atome.)
Ici, je vais vous expliquer comment trouver facilement les électrons de valence du carbone, de l’hydrogène ainsi que de l’oxygène à l’aide d’un tableau périodique.
Total des électrons de valence dans la molécule C3H6O
→ Électrons de Valence donnés par l’atome de carbone :
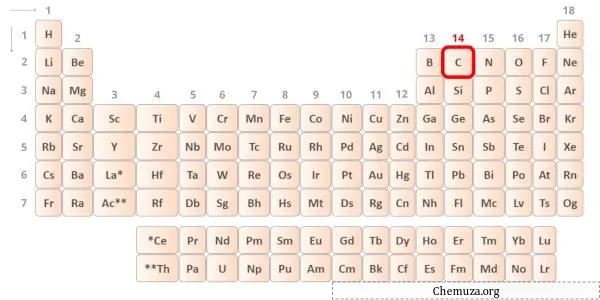
Le carbone est un élément du groupe 14 du tableau périodique. [1] Par conséquent, les électrons de valence présents dans le carbone sont 4 .
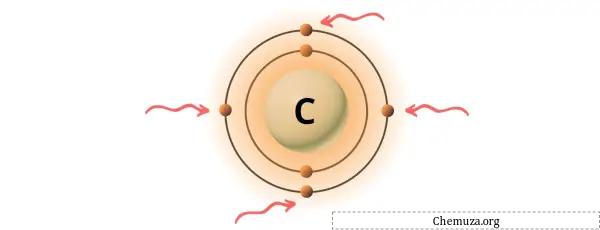
Vous pouvez voir les 4 électrons de valence présents dans l’atome de carbone, comme le montre l’image ci-dessus.
→ Électrons de Valence donnés par l’atome d’hydrogène :
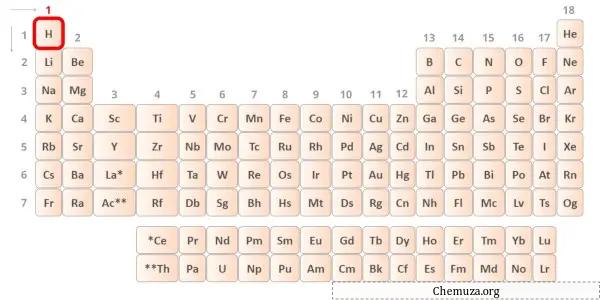
L’hydrogène est un élément du groupe 1 du tableau périodique.[2] Par conséquent, l’électron de valence présent dans l’hydrogène est 1 .

Vous pouvez voir qu’un seul électron de valence est présent dans l’atome d’hydrogène, comme le montre l’image ci-dessus.
→ Électrons de Valence donnés par l’atome d’oxygène :

L’oxygène est un élément du groupe 16 du tableau périodique. [3] Par conséquent, les électrons de valence présents dans l’oxygène sont 6 .
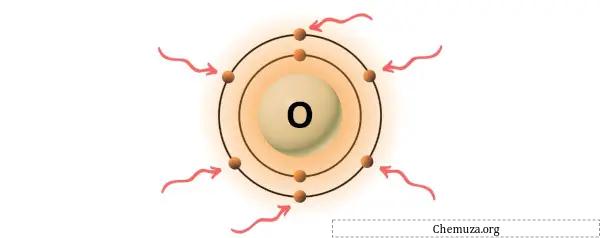
Vous pouvez voir les 6 électrons de valence présents dans l’atome d’oxygène, comme le montre l’image ci-dessus.
Ainsi,
Total des électrons de valence dans la molécule C3H6O = électrons de valence donnés par 3 atomes de carbone + électrons de valence donnés par 6 atomes d’hydrogène + électrons de valence donnés par 1 atome d’oxygène = 4(3) + 1(6) + 6 = 24 .
Étape 2 : Préparez l’esquisse
La structure de Lewis de l’acétone comporte trois atomes de carbone consécutifs dont un atome d’oxygène est attaché à l’atome de carbone central. Les atomes d’hydrogène sont liés aux deux atomes de carbone externes. L’atome d’oxygène est doublement lié à l’atome de carbone tandis que les atomes d’hydrogène sont liés simplement avec les atomes de carbone.
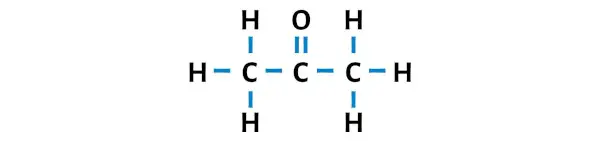
Étape 3 : Rendre les atomes externes stables
Ici, dans le croquis de la molécule C3H6O, vous pouvez voir que les atomes externes sont des atomes d’hydrogène et des atomes d’oxygène.
Les atomes d’hydrogène sont stables car ils possèdent 2 électrons (car l’hydrogène n’a besoin que de 2 électrons pour former un duplet stable).
Alors maintenant, rendons l’atome d’oxygène stable en formant un octet dessus.
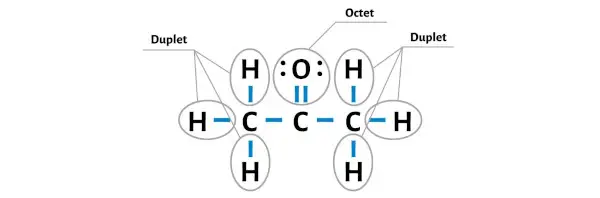
Vous pouvez maintenant voir que tous les atomes externes sont stables.
De plus, à l’étape 1, nous avons calculé le nombre total d’électrons de valence présents dans la molécule C3H6O.
La molécule C3H6O a un total de 24 électrons de valence et tous ces électrons de valence sont utilisés dans le schéma ci-dessus de C3H6O.
Par conséquent, la structure de Lewis ci-dessus de C3H6O (ou acétone) est une structure stable.
J’espère que vous avez compris les étapes ci-dessus.
Pour plus de pratique et une meilleure compréhension, vous pouvez essayer d’autres structures de Lewis répertoriées ci-dessous.
Essayez (ou au moins voyez) ces structures de Lewis pour une meilleure compréhension :
