Le sulfite de sodium, également connu sous le nom de Na2SO3, est une poudre cristalline blanche couramment utilisée comme conservateur dans l’industrie alimentaire et comme agent réducteur en photographie.
| Nom UICPA | Sulfite disodique |
| Formule moléculaire | Na2SO3 |
| Numero CAS | 7757-83-7 |
| Synonymes | Sulfite de sodium; Sulfite disodique ; Acide sulfureux, sel disodique ; Sulfonate de sodium ; Sulfite de sodium |
| InChI | InChI=1S/2Na.H2O3S/c;;1-4(2)3/h;;(H2,1,2,3)/q2*+1;/p-2 |
Propriétés du sulfite de sodium
Formule de sulfite de sodium
La formule chimique du sulfite de sodium est Na2SO3. Il est composé de deux ions Na+ et d’un ion SO32-. Les ions Na+ portent une charge positive tandis que l’ion SO32- porte une charge négative. Le sulfite de sodium est un composé ionique qui forme une poudre cristalline blanche.
Sulfite De Sodium Masse molaire
La masse molaire de Na2SO3 est de 126,04 g/mol. Cette valeur est obtenue en additionnant les masses atomiques de chaque élément du composé. Les masses atomiques du sodium, du soufre et de l’oxygène sont respectivement de 22,99 g/mol, 32,06 g/mol et 15,99 g/mol. La masse molaire est un paramètre important utilisé dans les calculs stœchiométriques et peut également être utilisée pour déterminer la quantité de substance présente dans un échantillon.
Point d’ébullition du sulfite de sodium
Na2SO3 a un point d’ébullition relativement élevé de 1 650 °C. Cela est dû aux fortes liaisons ioniques entre les ions Na+ et SO32-, qui nécessitent une grande quantité d’énergie pour se rompre. Le point d’ébullition est la température à laquelle une substance passe d’une phase liquide à une phase gazeuse. A cette température, la pression de vapeur du liquide est égale à la pression atmosphérique.
Sulfite de Sodium Point de fusion
Le point de fusion du Na2SO3 est de 33,4 °C. Ce point de fusion relativement bas est dû aux faibles forces intermoléculaires entre les molécules Na2SO3. Lorsqu’il est chauffé, les forces intermoléculaires sont surmontées et le solide Na2SO3 fond en liquide.
Densité du sulfite de sodium g/mL
La densité de Na2SO3 est de 2,633 g/mL. La densité est définie comme la masse d’une substance par unité de volume. La haute densité du Na2SO3 est due à sa nature ionique et à la présence de deux ions sodium par ion sulfite dans sa structure.
Sulfite De Sodium Poids moléculaire
Le poids moléculaire de Na2SO3 est de 126,04 g/mol. Cette valeur est obtenue en additionnant les poids atomiques de chaque élément du composé. Le poids moléculaire est un paramètre important utilisé dans les calculs stœchiométriques et peut également être utilisé pour déterminer la quantité de substance présente dans un échantillon.
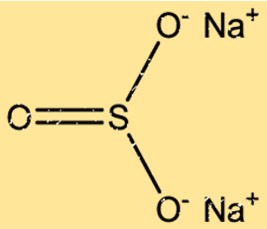
Structure du sulfite de sodium
Na2SO3 a une structure cristalline avec deux ions Na+ et un ion SO32- disposés selon un motif répétitif. Les ions Na+ sont disposés dans un réseau cubique à faces centrées, tandis que les ions SO32- occupent les sites octaédriques du réseau. Les liaisons ioniques entre les ions Na+ et SO32- aboutissent à une structure cristalline stable.
Solubilité du sulfite de sodium
Le Na2SO3 est hautement soluble dans l’eau, avec une solubilité de 22,4 g/100 mL à 20°C. Cette haute solubilité est due à la nature ionique du Na2SO3, qui lui permet de se dissocier dans l’eau et de former des ions Na+ et SO32-. La solubilité du Na2SO3 dans l’eau augmente avec la température, à mesure que l’énergie cinétique des molécules augmente et que davantage d’ions sont libérés dans la solution.
| Apparence | Poudre cristalline blanche |
| Gravité spécifique | 2,633 g/cm³ |
| Couleur | Incolore à blanc |
| Odeur | Inodore |
| Masse molaire | 126,04 g/mole |
| Densité | 2,633 g/mL |
| Point de fusion | 33,4 °C |
| Point d’ébullition | 1650 °C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Très soluble |
| Solubilité | Soluble dans le glycérol, légèrement soluble dans l’éthanol |
| La pression de vapeur | 0 mmHg à 20 °C |
| Densité de vapeur | N’est pas applicable |
| pKa | 6h35 |
| pH | 8,3 – 9,5 (solution à 5 %) |
Sécurité et dangers du sulfite de sodium
Le Na2SO3 peut être dangereux s’il n’est pas manipulé correctement. Il peut provoquer une irritation de la peau et des yeux et, en cas d’ingestion, il peut entraîner des nausées, des vomissements et des douleurs abdominales. Il peut également provoquer une irritation respiratoire en cas d’inhalation. De plus, le Na2SO3 peut réagir avec d’autres produits chimiques et produire des gaz toxiques, comme le dioxyde de soufre, qui peuvent être nocifs pour la santé. Il est donc important de porter un équipement de protection individuelle approprié lors de la manipulation du Na2SO3 et d’éviter toute exposition des yeux, de la peau et des muqueuses. Le Na2SO3 doit également être stocké dans un endroit frais, sec et bien ventilé, à l’écart des matériaux incompatibles.
| Symboles de danger | Xi, O |
| Description de la sécurité | Eviter le contact avec la peau et les yeux. En cas de contact, rincer immédiatement et abondamment à l’eau et consulter un médecin. Ne pas ingérer. Eviter l’inhalation de poussière. Porter un équipement de protection individuelle approprié. Tenir à l’écart de la chaleur, des étincelles et des flammes. |
| ID ONU | 1384 |
| Code SH | 283210 |
| Classe de danger | 8 – Substances corrosives |
| Groupe d’emballage | III |
| Toxicité | DL50 (orale, rat) – 1 640 mg/kg ; CL50 (inhalation, rat) – 63 mg/m³ |
Méthodes de synthèse du sulfite de sodium
Diverses méthodes peuvent synthétiser Na2SO3.
Une méthode courante consiste à faire réagir l’hydroxyde de sodium avec du dioxyde de soufre gazeux en présence d’eau. La réaction produit du Na2SO3 et de l’eau comme sous-produits.
Dans une autre méthode, le carbonate de sodium réagit avec le dioxyde de soufre gazeux en présence d’eau, produisant du Na2SO3 et du dioxyde de carbone gazeux. Pour augmenter le rendement en Na2SO3, on peut effectuer cette réaction à des températures et des pressions élevées.
La réaction du bisulfite de sodium avec l’hydroxyde de sodium peut synthétiser du Na2SO3. Cette réaction produit du Na2SO3, de l’eau et du chlorure de sodium comme sous-produits.
Une autre méthode consiste à faire réagir du sulfure de sodium avec du dioxyde de soufre gazeux en présence d’eau pour produire du Na2SO3 et du sulfure d’hydrogène gazeux.
Pour synthétiser Na2SO3, il faut traiter le sulfate de sodium avec du dioxyde de soufre gazeux en présence d’un agent réducteur, tel que le charbon actif. Cette réaction produit du Na2SO3 et du dioxyde de carbone.
Chacune de ces méthodes présente ses propres avantages et inconvénients, et le choix de la méthode dépend de divers facteurs, tels que le rendement souhaité, la pureté et le coût du produit, ainsi que la disponibilité des réactifs et des équipements.
Utilisations du sulfite de sodium
Na2SO3 a plusieurs utilisations industrielles et commerciales importantes, notamment :
- Photographie : Utilisé comme agent réducteur et conservateur dans les solutions de développement photographique. Cela aide à stabiliser l’image et à éviter la décoloration.
- Traitement de l’eau : Utilisé pour éliminer le chlore et l’excès d’oxygène de l’eau dans les usines de traitement de l’eau industrielles et municipales. Il permet également de prévenir la corrosion des canalisations et des équipements.
- Industrie du papier et de la pâte à papier : utilisé dans la production de papier et de pâte à papier pour blanchir et réduire la teneur en lignine de la pâte. Cela contribue à améliorer la qualité et la couleur du papier.
- Industrie alimentaire : Utilisé comme conservateur et antioxydant dans l’industrie alimentaire. Il aide à prévenir la décoloration et la détérioration des aliments, tels que les fruits secs, le vin et la bière.
- Industrie textile : utilisé comme agent réducteur et agent de blanchiment dans l’industrie textile pour éliminer l’excès de colorant et améliorer la solidité des couleurs des tissus.
- Industrie chimique : Utilisé comme agent réducteur dans diverses réactions chimiques, comme dans la production de colorants, de produits pharmaceutiques et de polymères.
- Autres utilisations : Également utilisé dans la fabrication de détergents, de produits en cuir et de produits de soins personnels, tels que des colorants capillaires et des shampoings.
Des questions:
Q : Quel est le sulfite de sodium normal dans une chaudière ?
R : La concentration normale de Na2SO3 dans une chaudière se situe généralement entre 20 et 40 parties par million (ppm), en fonction de la pression de fonctionnement et d’autres facteurs.
Q : Comment équilibrer le dioxyde de soufre avec l’hydroxyde de sodium pour former du sulfite de sodium et de l’eau ?
R : Pour équilibrer l’équation de la réaction du dioxyde de soufre et de l’hydroxyde de sodium pour former du Na2SO3 et de l’eau, vous devez vous assurer qu’il y a un nombre égal d’atomes de chaque élément des deux côtés de l’équation. L’équation équilibrée serait SO2 + 2NaOH → Na2SO3 + H2O.
Q : Qu’est-ce que le sulfite de sodium ?
R : Na2SO3 est un composé cristallin blanc couramment utilisé dans diverses applications industrielles et commerciales, telles que la photographie, le traitement de l’eau, la production de papier et la conservation des aliments.
Q : Quelle est la formule du sulfite de sodium ?
R : La formule du sulfite de sodium est Na2SO3.
Q : Le sulfite de sodium est-il une base ?
R : Na2SO3 est un sel d’une base forte (hydroxyde de sodium) et d’un acide faible (acide sulfureux) et possède donc des propriétés basiques. Cependant, elle n’est généralement pas considérée comme une base solide.
Q : Le sulfite de sodium est-il stable dans l’eau ?
R : Le Na2SO3 est relativement stable dans l’eau, mais il peut se décomposer progressivement avec le temps, notamment en présence d’oxygène ou d’autres agents oxydants.
Q : Le sulfite de sodium est-il inflammable ?
R : Le Na2SO3 n’est pas inflammable, mais il peut réagir avec certains agents oxydants et libérer du dioxyde de soufre, qui est un irritant respiratoire et peut être inflammable.
Q : Où acheter du sulfite de sodium localement ?
R : Le Na2SO3 peut être acheté auprès d’entreprises de fourniture de produits chimiques, de fournisseurs industriels et de certains détaillants spécialisés. Il peut également être disponible dans certaines quincailleries locales ou centres de rénovation domiciliaire.
Q : Quels aliments contiennent du sulfite de sodium ?
R : Le Na2SO3 est couramment utilisé comme conservateur dans les aliments tels que le vin, la bière, les fruits secs et certaines viandes transformées.
Q : Quel produit est égal au sulfite de sodium ?
R : Le bisulfite de sodium est un composé similaire qui peut être utilisé comme substitut au Na2SO3 dans certaines applications. D’autres substituts peuvent inclure le métabisulfite de sodium ou le métabisulfite de potassium.
