Le sulfite de magnésium (MgSO3) est un composé composé d’ions magnésium et sulfite. Il est couramment utilisé comme conservateur alimentaire et antioxydant dans l’industrie alimentaire.
| Nom UICPA | Sulfite de magnésium |
| Formule moléculaire | MgSO3 |
| Numero CAS | 7757-88-2 |
| Synonymes | Sulfonate de magnésium, trioxyde de soufre de magnésium, E-536 |
| InChI | InChI=1S/Mg.H2O3S/c;1-4(2)3/h;(H2,1,2,3)/q+2;/p-2 |
Propriétés du sulfite de magnésium
Formule de sulfite de magnésium
Le sulfite de magnésium a une formule chimique MgSO3, ce qui indique qu’il est composé d’un atome de magnésium, d’un atome de soufre et de trois atomes d’oxygène. L’ion sulfite est un ion polyatomique de formule SO3 2-, constitué d’un atome de soufre central lié à trois atomes d’oxygène. L’ion Mg a une charge de +2, tandis que l’ion SO3 2- a une charge de -2, ce qui rend le composé électriquement neutre.
Sulfite De Magnésium Masse molaire
La masse molaire du MgSO3 est de 104,37 g/mol, ce qui correspond à la somme des masses atomiques d’un atome de magnésium, d’un atome de soufre et de trois atomes d’oxygène. Cette valeur est importante pour calculer la quantité de MgSO3 requise pour une réaction particulière, ainsi que pour déterminer la stœchiométrie des équations chimiques.
Point d’ébullition du sulfite de magnésium
Le MgSO3 se décompose avant d’atteindre son point d’ébullition, il n’a donc pas de point d’ébullition spécifique. Au lieu de cela, il commence à se décomposer en oxyde de magnésium et en dioxyde de soufre à des températures supérieures à 700°C. Ce processus de décomposition peut être accéléré par l’exposition à l’air ou à l’humidité, faisant du MgSO3 un composé relativement instable.
Sulfite de magnésium Point de fusion
Le point de fusion du MgSO3 est d’environ 150°C. À cette température, le composé commence à se décomposer en oxyde de magnésium et en dioxyde de soufre. Le processus de décomposition est exothermique, c’est-à-dire qu’il dégage de la chaleur. Le point de fusion du MgSO3 est important pour comprendre ses propriétés en tant que solide, telles que sa solubilité et sa structure cristalline.
Densité du sulfite de magnésium g/mL
La densité du MgSO3 varie en fonction de sa forme physique, mais elle varie généralement de 2,5 à 3,0 g/mL. Cette valeur est importante pour déterminer la masse d’un volume donné de MgSO3, ainsi que pour comprendre son comportement en solution. La densité du MgSO3 peut également être utilisée pour calculer sa densité, qui est une mesure de sa densité relative par rapport à l’eau.
Sulfite De Magnésium Poids moléculaire
Le poids moléculaire du MgSO3 est de 104,37 g/mol. Cette valeur est importante pour comprendre les propriétés physiques et chimiques du composé, ainsi que pour calculer la quantité de MgSO3 requise pour une réaction particulière. Le poids moléculaire du MgSO3 peut être calculé en additionnant les poids atomiques d’un atome de magnésium, d’un atome de soufre et de trois atomes d’oxygène.
Structure du sulfite de magnésium
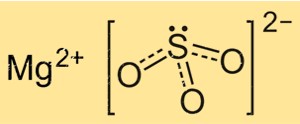
La structure du MgSO3 est basée sur un réseau cristallin d’ions Mg+2 et d’ions SO3 2-. Les ions Mg+2 sont entourés de six atomes d’oxygène, disposés de manière octaédrique, tandis que les ions SO3 2- sont liés aux ions magnésium par l’intermédiaire de deux atomes d’oxygène. La structure cristalline du MgSO3 est importante pour comprendre ses propriétés physiques et chimiques, telles que sa solubilité et sa réactivité.
Solubilité du sulfite de magnésium
Le MgSO3 est peu soluble dans l’eau, avec une solubilité d’environ 7,5 g/L à température ambiante. Cette faible solubilité est due à la structure cristalline du composé, qui rend difficile la pénétration et la dissolution des molécules d’eau dans le solide. Le MgSO3 est plus soluble dans les solutions acides, car l’acide peut réagir avec l’ion sulfite pour former du bisulfite et de l’acide sulfureux. La solubilité du MgSO3 est importante pour comprendre son comportement en solution, ainsi que pour déterminer son efficacité en tant que conservateur alimentaire et antioxydant.
| Apparence | Poudre ou cristaux blancs |
| Gravité spécifique | 2,5 – 3,0 |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 104,37 g/mole |
| Densité | 2,5 à 3,0 g/ml |
| Point de fusion | Environ 150°C |
| Point d’ébullition | Se décompose au-dessus de 700°C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Peu soluble, environ 7,5 g/L à température ambiante |
| Solubilité | Plus soluble dans les solutions acides |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | N’est pas applicable |
| pH | N’est pas applicable |
Sécurité et dangers du sulfite de magnésium
Le MgSO3 n’est pas considéré comme une substance très dangereuse. Cependant, il peut provoquer une irritation des yeux, de la peau et des voies respiratoires par contact ou par inhalation. L’ingestion de MgSO3 peut provoquer une irritation gastro-intestinale et éventuellement des vomissements. Une exposition prolongée à des concentrations élevées peut entraîner des lésions pulmonaires ou une irritation respiratoire. Il est donc important de manipuler le MgSO3 avec précaution, en portant un équipement de protection individuelle approprié et en évitant l’inhalation de poussières ou de fumées. Le MgSO3 doit être stocké dans un endroit frais, sec et bien ventilé, à l’écart des matières incompatibles telles que les oxydants puissants, les acides et les bases.
| Symboles de danger | Aucun |
| Description de la sécurité | Eviter l’inhalation de poussières ou de fumées. Porter un équipement de protection individuelle approprié. |
| Numéros d’identification de l’ONU | Non réglementé |
| Code SH | 2833.29 |
| Classe de danger | Non classé comme dangereux |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | Faible toxicité, peut provoquer une irritation des yeux, de la peau et des voies respiratoires par contact ou par inhalation. L’ingestion peut provoquer une irritation gastro-intestinale et éventuellement des vomissements. Une exposition prolongée à des concentrations élevées peut entraîner des lésions pulmonaires ou une irritation respiratoire. |
Méthodes de synthèse du sulfite de magnésium
On peut synthétiser le MgSO3 par diverses méthodes, telles que la réaction de l’acide sulfureux ou du dioxyde de soufre gazeux avec de l’oxyde de magnésium ou de l’hydroxyde de magnésium.
Dans une méthode, la réaction de l’oxyde de magnésium avec l’eau forme de l’hydroxyde de magnésium , qui réagit ensuite avec l’acide sulfureux pour produire du MgSO3.
Une autre méthode consiste à faire réagir de l’hydroxyde de magnésium avec du dioxyde de soufre gazeux en présence d’eau pour former du MgSO3.
Dans une autre méthode, la réaction du sulfate de magnésium avec le sulfite de sodium ou le sulfite de potassium peut synthétiser du MgSO3. Cette réaction produit un précipité de MgSO3, que les chercheurs peuvent isoler par filtration et séchage.
La réaction de l’acétate de magnésium avec le dioxyde de soufre gazeux en présence d’eau peut préparer du MgSO3. Ensuite, lavez et séchez le précipité de MgSO3 obtenu.
On peut utiliser ces méthodes pour produire du MgSO3 pour diverses applications, notamment la production de papier et de pâte à papier, la transformation des aliments et des boissons et le traitement de l’eau.
Utilisations du sulfite de magnésium
Le MgSO3 a diverses utilisations dans différentes industries. Voici quelques-unes de ses utilisations courantes :
- Traitement de l’eau : utilisé comme désoxygénant dans le traitement de l’eau des chaudières pour prévenir la corrosion et la formation de tartre.
- Transformation des aliments et des boissons : utilisé comme conservateur et antioxydant dans la transformation des aliments et des boissons pour prolonger la durée de conservation et prévenir la détérioration.
- Production de pâtes et papiers : Utilisé comme agent de blanchiment dans l’industrie des pâtes et papiers pour améliorer la brillance et la couleur des produits en papier.
- Fabrication textile : Utilisé comme agent réducteur dans la fabrication textile pour éliminer l’excès d’oxygène et améliorer la qualité du produit fini.
- Agriculture : Utilisé en pulvérisation foliaire pour améliorer la croissance des plantes et augmenter les rendements des cultures.
- Médecine : Utilisé en médecine traditionnelle pour ses propriétés antioxydantes et anti-inflammatoires.
- Cosmétiques : Utilisé dans les cosmétiques comme émulsifiant, stabilisant et ajusteur de pH.
- Autres utilisations : Également utilisé dans la production d’adhésifs, de peintures et de revêtements, ainsi que dans les processus de traitement des eaux usées.
Des questions:
Q : Quelle est la formule du sulfite de magnésium ?
R : La formule du sulfite de magnésium est MgSO3.
Q : Quelle quantité de sulfite de magnésium contient un échantillon de 2,4 moles ?
R : Dans un échantillon de 2,4 moles de MgSO3, il y a 2,4 moles de MgSO3.
Q : Quel est le pourcentage en masse de chaque élément dans 1 mole de sulfite de magnésium ?
R : Dans une mole de sulfite de magnésium, le pourcentage en masse de magnésium est de 32,44 %, le soufre est de 29,44 % et l’oxygène est de 38,12 %.
Q : Le sulfite de magnésium arrête-t-il les crampes musculaires ?
R : Il n’existe aucune preuve scientifique suggérant que le MgSO3 puisse arrêter les crampes musculaires. Cependant, le sulfate de magnésium (sel d’Epsom) a été utilisé à cette fin.
Q : Quel est l’effet de l’ajout de sulfite de magnésium dans les réactions ?
R : L’ajout de MgSO3 peut agir comme agent réducteur dans certaines réactions en éliminant l’oxygène. Il peut également agir comme conservateur et antioxydant dans certaines applications.
Q : Le sulfite de magnésium est-il ionique ou moléculaire ?
R : MgSO3 est un composé ionique.
