Le bisulfite de sodium (NaHSO3) est un composé chimique utilisé comme conservateur alimentaire et dans diverses applications industrielles. Il agit en inhibant la croissance des bactéries et en empêchant l’oxydation.
| Nom UICPA | Hydrogénosulfite de sodium |
| Formule moléculaire | NaHSO3 |
| Numero CAS | 7631-90-5 |
| Synonymes | Bisulfite de sodium, Sulfite acide de sodium, Hydrogénosulfite de sodium, Hydrogénosulfite de sodium, Sulfite de sodium monohydraté |
| InChI | InChI=1S/Na.H2O3S/c;1-4(2)3/h;(H2,1,2,3)/q+1;/p-1 |
Propriétés du bisulfite de sodium
Formule de bisulfite de sodium
La formule chimique du bisulfite de sodium est NaHSO3. Cette formule indique le nombre et le type d’atomes présents dans une seule molécule de bisulfite de sodium. La formule est cruciale pour déterminer le comportement du bisulfite de sodium dans différentes réactions chimiques et conditions physiques.
Bisulfite De Sodium Masse molaire
NaHSO3 a une masse molaire de 104,06 g/mol. Il s’agit de la somme des masses atomiques des éléments constitutifs d’une seule molécule de NaHSO3. La masse molaire est une propriété physique importante qui permet de déterminer la quantité d’une substance dans un échantillon donné.
Point d’ébullition du bisulfite de sodium
Le point d’ébullition de NaHSO3 est de 150°C. Il s’agit de la température à laquelle la forme liquide du NaHSO3 commence à se transformer en gaz. Le point d’ébullition est une propriété physique cruciale qui détermine le comportement d’une substance dans différentes conditions de température.
Bisulfite de sodium Point de fusion
Le point de fusion de NaHSO3 est de 150°C. C’est la température à laquelle la forme solide de NaHSO3 commence à se transformer en liquide. Le point de fusion est une propriété physique essentielle qui permet de déterminer le comportement d’une substance dans différentes conditions de température.
Densité du bisulfite de sodium g/mL
La densité de NaHSO3 est de 1,48 g/mL. Cela fait référence à la quantité de masse présente dans un volume donné de NaHSO3. La densité est une propriété physique importante qui permet de déterminer le comportement d’une substance dans différentes conditions de pression et de température.
Bisulfite De Sodium Poids moléculaire
Le poids moléculaire de NaHSO3 est de 104,06 g/mol. Il s’agit de la somme des poids atomiques des éléments constitutifs d’une seule molécule de NaHSO3. Le poids moléculaire est une propriété physique essentielle qui permet de déterminer la quantité d’une substance dans un échantillon donné.
Structure du bisulfite de sodium
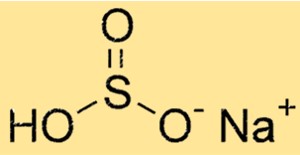
NaHSO3 a une structure moléculaire composée d’un cation sodium (Na+) et d’un anion HSO3-. L’anion est constitué d’un atome de soufre, de trois atomes d’oxygène et d’un atome d’hydrogène. La structure de NaHSO3 détermine ses propriétés chimiques et physiques.
Solubilité du bisulfite de sodium
NaHSO3 est hautement soluble dans l’eau, avec une solubilité de 62 g/100 mL à 20°C. Il est également soluble dans le glycérol et légèrement soluble dans l’alcool. Sa solubilité dans l’eau en fait un réactif utile dans diverses réactions chimiques.
| Apparence | Poudre cristalline blanche |
| Gravité spécifique | 1,48 |
| Couleur | Blanc à légèrement jaune |
| Odeur | Odeur sulfureuse |
| Masse molaire | 104,06 g/mole |
| Densité | 1,48 g/ml |
| Point de fusion | 150°C |
| Point d’ébullition | 150°C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Très soluble |
| Solubilité | Soluble dans l’éthanol |
| La pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | 6,97 |
| pH | 4,5-5,5 (solution à 5 %) |
Sécurité et dangers du bisulfite de sodium
NaHSO3 peut être dangereux s’il est ingéré, inhalé ou entre en contact avec la peau ou les yeux. Cela peut provoquer des irritations cutanées, des lésions oculaires, des problèmes respiratoires et digestifs. Une exposition prolongée peut entraîner des problèmes de santé plus graves. Il est important de manipuler et de stocker NaHSO3 avec soin, en utilisant des équipements de protection individuelle comme des gants, des lunettes et des respirateurs. Il doit être tenu à l’écart des matières combustibles et des substances incompatibles. En cas de contact accidentel ou d’ingestion, des soins médicaux immédiats doivent être recherchés. Des procédures appropriées de stockage et de manipulation doivent être suivies pour éviter tout danger potentiel.
| Symboles de danger | Crâne et os croisés, Corrosif |
| Description de la sécurité | Évitez tout contact avec la peau, les yeux et les vêtements. Ne pas ingérer ni inhaler. Utilisez un équipement de protection approprié. |
| Numéros d’identification de l’ONU | UN2693 |
| Code SH | 28321000 |
| Classe de danger | 8 |
| Groupe d’emballage | III |
| Toxicité | Très toxique par ingestion ou inhalation. Peut provoquer une irritation de la peau et des yeux, des problèmes respiratoires et digestifs. Une exposition prolongée peut entraîner de graves problèmes de santé. |
Méthodes de synthèse du bisulfite de sodium
Il existe différentes méthodes pour synthétiser NaHSO3, mais la plus courante consiste à faire réagir le carbonate de sodium et le dioxyde de soufre.
Pour produire une solution NaHSO3, mélangez une solution de carbonate de sodium avec du dioxyde de soufre gazeux. La réaction dégage de la chaleur et nécessite une cuve de réaction dotée d’une ventilation adéquate.
Une autre méthode implique la réaction de l’hydroxyde de sodium avec du dioxyde de soufre gazeux pour produire une solution de sulfite de sodium, qui est ensuite acidifiée pour produire une solution de NaHSO3. Pour de grandes quantités de NaHSO3, cette méthode s’avère utile.
Pour synthétiser NaHSO3, l’acide sulfurique réagit avec le sulfite de sodium , créant une solution de NaHSO3. Cette méthode s’avère bénéfique lorsqu’il faut une solution plus concentrée de NaHSO3.
Utilisations du bisulfite de sodium
NaHSO3 a un large éventail d’utilisations dans diverses industries. Voici quelques-unes de ses utilisations courantes :
- Industrie alimentaire – Utilisé comme conservateur alimentaire pour empêcher la croissance des bactéries et prolonger la durée de conservation des produits alimentaires comme les fruits et légumes en conserve, les jus et le vin.
- Traitement de l’eau – Utilisé comme agent réducteur pour éliminer l’excès de chlore des systèmes de traitement de l’eau potable et des eaux usées.
- Industrie textile – Utilisé comme agent de blanchiment pour éliminer les colorants résiduels des textiles.
- Industrie photographique – Utilisé comme agent de développement dans le traitement photographique.
- Forage pétrolier – Utilisé comme inhibiteur de corrosion et dans les systèmes de récupération pour éliminer l’oxygène et prévenir la corrosion lors des opérations de forage pétrolier et gazier.
- Produits pharmaceutiques – Utilisés comme antioxydant et comme agent réducteur dans la fabrication de certains produits pharmaceutiques.
- Soins personnels – Utilisé comme agent de lissage des cheveux et dans la production de certains produits de soins personnels comme les shampoings et les revitalisants.
- Autres utilisations – Utilisé dans la production de papier et de pâte à papier, comme réactif de laboratoire et comme agent chélateur d’ions métalliques.
Des questions:
Q : Qu’est-ce que NaHSO3 ?
R : NaHSO3 est la formule chimique du bisulfite de sodium, un sel utilisé à diverses fins dans différentes industries.
Q : Quel est le pH approximatif de NaHSO3 0,015 M ?
R : Le pH approximatif de NaHSO3 0,015 M est d’environ 7. Cette solution est neutre car ce n’est ni un acide ni une base.
Q : Le NaHSO3 est-il acide ou basique ?
R : NaHSO3 est légèrement acide car il peut donner un ion hydrogène dans l’eau pour former des ions HSO3- et H+.
Q : Quel est le nombre d’oxydation du soufre (S) dans NaHSO3, l’un des réactifs utilisés dans cette expérience ?
R : Le nombre d’oxydation du soufre (S) dans NaHSO3 est de +4.
Q : Que fait NaHSO3 ?
R : NaHSO3 est utilisé comme agent réducteur et comme source de dioxyde de soufre. Il peut également agir comme antioxydant et conservateur dans les produits alimentaires et pharmaceutiques.
Q : Si vous souhaitez préparer 1,00 kg d’I2, quelles masses de NaIO3 et NaHSO3 sont nécessaires ?
R : L’équation chimique équilibrée de la réaction entre NaIO3 et NaHSO3 pour former I2 est : 5NaIO3 + NaHSO3 + 3H2O → 3I2 + 5NaSO4 + 3H2SO4. En utilisant la stœchiométrie, vous auriez besoin de 3,33 kg de NaIO3 et de 1,00 kg de NaHSO3 pour préparer 1,00 kg de I2. .
Q : Pourquoi avons-nous ajouté du bisulfite de sodium à la fin de la réaction ?
R : NaHSO3 est ajouté à la fin de certaines réactions chimiques pour éliminer l’excès de brome, qui peut être nocif ou interférer avec les étapes ultérieures du processus.
Q : Qu’est-ce que le bisulfite de sodium ?
R : NaHSO3 est un sel utilisé pour ses propriétés réductrices, antioxydantes et conservatrices dans diverses industries, notamment l’alimentation, les produits pharmaceutiques et le traitement de l’eau.
Q : Comment le bisulfite de sodium élimine-t-il le brome ?
R : NaHSO3 réagit avec le brome pour former du bromure de sodium et du dioxyde de soufre gazeux, éliminant ainsi efficacement l’excès de brome d’une solution.
Q : Qu’est-ce que le complexe de bisulfite de sodium de ménadione ?
R : Le complexe de bisulfite de sodium ménadione est un composé synthétique utilisé comme source de vitamine K dans certains compléments alimentaires et produits alimentaires pour animaux.
Q : À quoi sert le bisulfite de sodium ?
R : NaHSO3 est utilisé comme agent réducteur, antioxydant et conservateur dans diverses industries, notamment l’alimentation, les produits pharmaceutiques, le traitement de l’eau et le forage pétrolier. Il peut également être utilisé comme agent de lissage des cheveux et dans le traitement photographique.
